Para dejar un comentario Regístrate aquí o si ya tienes una cuenta debes Iniciar sesión

Porcinos
junio 6, 2023
Situación Actual de la Diarrea Epidémica Porcina y Estrategias de Control en Granjas Porcinas
Avalos, G.P.
El virus de la Diarrea Epidémica Porcina (PED, por sus siglas en inglés), fue primeramente reconocido en el Reino Unido en 1971, durante el 2013, se han tenido reportes en Europa y Asia. En Estados Unidos el departamento de Agricultura de Estados Unidos confirmó el diagnóstico por primera vez el 17 de Mayo del presente en Iowa. En México, el laboratorio Investigación Aplicada SA de CV confirmó el primer diagnóstico de PED a través de un ensayo inmunocromatográfico el día 30 de Julio de 2013 y el día 08 de Agosto, se emitió un diagnóstico confirmatorio por medio de la técnica de PCR, por parte del laboratorio de bioseguridad nivel 3, de la Comisión México-Americana para la Erradicación de la Fiebre Aftosa y otras Enfermedades Exóticas (CPA). Al día de hoy, se tienen otros casos positivos por la prueba de inmunocromatografía en la zona centro de México, mismos que están por confirmarse mediante pruebas moleculares. El agente etiológico es un coronavirus, el cual es distinguible del virus de Gastroenteritis Transmisible (GET) solo por pruebas de laboratorio. La presentación de PED en cerdos neonatos es más grave, debido a que la morbilidad y mortalidad puede ser de 80 al 100%. La transmisión ocurre por vía fecal-oral, al momento no se ha determinado si vectores y reservorios están implicados en la transmisión de la enfermedad. Las pérdidas económicas se deben directamente a la mortalidad generada y los costos de producción se incrementan por la vacunación y bioseguridad. Al momento no existe un tratamiento efectivo, sin embargo el uso de inmunoglobulinas de origen aviar específicas para el virus PED en lechones han mostrado reducción en la mortalidad e incremento de la tasa de supervivencia de los lechones (Kweon et al., 2000), por lo que son consideradas una opción en el manejo y control de la enfermedad. Existen vacunas en Japón, Corea del Sur y China, pero no en Europa, Estados Unidos ni México. PED, no se encuentra en la lista de enfermedades de la Organización Mundial de Salud Animal (OIE), por lo que no existen medidas de cuarentenas o restricciones en el movimiento a nivel internacional y/o interestatal.
Características del agente
PED es un virus ARN de cadena sencilla, polaridad positiva, perteneciente al grupo 1 de los Coronavirus con un diámetro promedio de 130 nm, el gen S es una porción que codifica para múltiples factores de virulencia (Li et al., 2012) y que es utilizado para el diagnóstico por PCR.
Variaciones genéticas significativas han sido documentadas en los casos de PED en China (Yang et al., 2013). El genoma completo se encuentra disponible en el GenBank y ha sido descrita una identidad de nucleótidos del 99.5% con cepas Chinas y comparado con la cepa de referencia CV777 se han detectado varias inserciones y deleciones en el genoma (Marthaler et al., 2013; Kocherhans et al., 2001). PED es sensible al éter y al cloroformo y disminuye su infectividad a temperaturas superiores a 60°C. El virus de la diarrea epidémica porcina es sensible a los principales principios activos de los desinfectantes comunes, incluyendo cresol, hidróxido de sodio (2%), formalina (1%), carbonato de sodio (4% anhídrido ó 10% cristalino, con 0.1% de detergente), detergentes iónicos o no iónicos, iodo (1%), ácido fosfórico, solventes lipídicos como el cloroformo, hipoclorito de sodio y compuestos fenólicos (Pospischil et al., 2002).
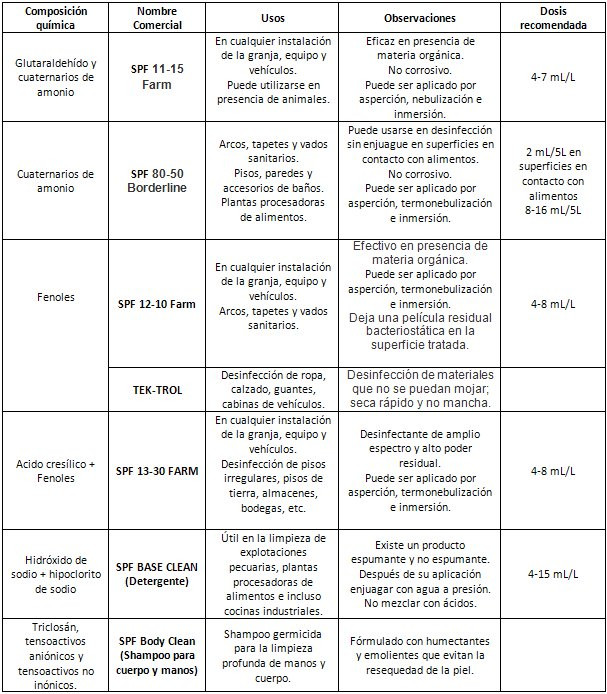
En Investigación Aplicada se cuenta con una amplia gama de detergentes y desinfectantes, compatibles entre si y que pueden adecuarse en todas las condiciones, dada su constitución química son efectivos para la eliminación del virus PED y otros agentes patógenos comunes en las empresas porcinas.
En el siguiente cuadro se muestran los nombres comerciales y su composición química, además de algunas características de interés en los detergentes y desinfectantes seleccionados, así como la dosis recomendada de cada producto.
Signos clínicos
La severidad de la enfermedad es variable y depende del estatus epidemiológico de la granja. Los signos primarios y más comunes son la presencia de diarrea y vómito. En granjas sin antecedentes de exposición como lo son las granjas de México, se presenta vómito, diarrea acuosa y pérdida del apetito en cerdos de todas las edades. La morbilidad es cercana al 100%.
- Lechones: diarrea acuosa, deshidratación, acidosis metabólica y mortalidad entre 50 y 80%, aunque en las descripciones clínicas de granjas en México, reportan mortalidades del 100% de los recién nacidos.
- Crecimiento y Engorda: diarrea, anorexia, depresión, alta morbilidad pero baja mortalidad (1-3%).
En el caso de granjas endémicas los casos clínicos se caracterizan por diarrea persistente en cerdos recién destetados.
Periodo de incubación
Experimentalmente el periodo de incubación ha sido demostrado en aproximadamente 36 horas después de la inoculación, cuando el virus PED es introducido a una granja que nunca había estado expuesta al virus, los signos clínicos aparecen de 4 a 5 días y el virus es eliminado por parte de los animales por 7-9 días (Harris et al., 2012; Pospischil et al., 2012).
Características patológicas
Las lesiones macro y microscópicas son similares a las descritas para el virus de GET. El estómago se encuentra comúnmente vacío debido al vómito. El intestino delgado comúnmente se encuentra lleno de fluido y con una apariencia delgada debido a la atrofia severa de la mucosa.
Microscópicamente, se observa vacuolización citoplasmática y exfoliación de enterocitos con acortamiento y fusión de las vellosidades, pero en menor intensidad que en GET. No se observan lesiones microscópicas en colon. Interesantemente en estudios de ultraestructura se observan partículas virales intracitoplasmáticas y cambios en las células epiteliales del intestino delgado y colon (Pospischil et al., 2002, Xu et al., 2013).
Inmunología
Las hembras gestantes pueden requerir aproximadamente tres semanas en desarrollar suficientes anticuerpos que sirvan para proteger a sus camadas del virus de PED, los lechones requieren ingerir suficiente cantidad de calostro para que la inmunidad sea protectiva, la supervivencia neonatal retorna a la normalidad después de un periodo de 3-4 semanas después del Feedback y que se inició la exposición, sin embargo la inmunidad generada mediante la exposición no durará toda la vida productiva del cerdo.
Modo de transmisión
- Transmisión Directa: fecal-oral, los signos clínicos pueden observarse de 4 a 5 días después de la introducción de cerdos infectados.
- Transmisión indirecta: personal contaminado, equipo y otros fómites pueden favorecer la introducción de PED a las granjas susceptibles.
Diagnóstico diferencial
- Gastroenteritis Viral: El virus PED es similar pero antigénicamente distinto del virus de Gastroenteritis Transmisible. El rotavirus porcino Tipo A y B también son causa de enfermedades entéricas con presentación clínica similar.
- Gastroenteritis bacteriana: Clostridium spp., E. coli, Salmonella spp., Brachyspira spp., Lawsonia intracellularis.
- Gastroenteritis parasitaria: Isospora suis, Cryptosporidium spp, Nemátodos.
Pruebas disponibles
Inmunofluorescencia, inmunohistoquímica, microscopia electrónica, ELISA, pero son técnicas con suficiente sensibilidad y especificidad. La reacción en Cadena de la Polimerasa (PCR) transcriptasa reversa utilizando primers dirigidos al gen M y gen S.
En Investigación Aplicada SA de CV el diagnóstico de PED se basa en una prueba rápida de Inmunocromatografía para detectar antígeno en heces, además del diagnóstico por histopatología considerando el grado de lesión de las vellosidades intestinales, se cuenta también con los elementos para hacer la prueba rápida contra GET y con los primers específicos para la misma enfermedad. El tipo de muestra requerida para el diagnóstico son heces de cerdos con diarrea que cursen con la enfermedad de forma aguda (máximo 6 horas de iniciada la manifestación clínica), las heces deberán ser enviadas en refrigeración y remitidas de forma inmediata al laboratorio, se pueden remitir fragmentos de intestino ligados y conservados en refrigeración, adicionalmente se puede enviar tejido en solución de formalina amortiguada al 10% para su análisis histopatológico.
Potencial zoonótico
PED no es transmisible a humanos por lo que no es considerado un problema de salud pública (Pospischil et al., 2002).
Manejo PED en granjas porcinas
La clave para un manejo exitoso de atenuación de los efectos negativos de PED es la exposición rápida y completa de toda una población. El virus se propaga fácilmente usando materia fecal de animales enfermos, tracto gastrointestinal de neonatos infectados o mediante el contacto directo con animales infectados. La eliminación en el pie de cría generalmente se logra utilizando de manera inmediata Feedback de material infectado, acompañado del cierre de granja, seguida de la introducción de animales centinelas. Todas las cerdas de reemplazo deberán ser sometidas a Feedback por un periodo de cuatro a seis meses en la granja. Pueden utilizarse animales centinelas para determinar que el virus ha sido eliminado antes de reanudar el reemplazo de la granja.
El material para la exposición debe consistir en materia fecal de animales infectados, animales con diarrea y el tracto gastrointestinal (vísceras) de lechones infectados/cerdos con diarrea. Para el máximo contenido viral, se deberá sacrificar a los lechones enfermos en las primeras seis horas del inicio de los signos clínicos. Las vísceras deberán ser procesadas, por ejemplo, con una licuadora, con la finalidad de obtener un macerado más homogéneo. Puede utilizarse agua fría para extender/transportar el material de exposición, ya que el virus en sensible al agua caliente y al cloro contenido en la misma. Distribuir el material de exposición antes o al inicio del periodo de alimentación. Congelar una cantidad de material visceral inmediatamente para utilizarlo en re-exposiciones posteriores. Se deberá ser agresivo y continuo con la exposición. Los signos clínicos deberán aparecer 12-36 horas después de la exposición. No se deberá asumir que cada animal ha recibido una dosis infectante. Se deberá examinar a las cerdas de forma individual por lo menos una vez al día (se prefiere dos veces al día) para identificar aquellos que clínicamente están afectados. Diarrea y vómito deben ser los signos más evidentes. Para animales en los cuales existan dudas de la infección se deberá considerar la ingestión de alimento y se debe tomar la temperatura rectal. Es útil marcar cada cerda que muestra signos evidentes para determinar el éxito de la exposición.
Para evaluar la exposición, es deseable que más del 90% de los animales desarrollen signos clínicos. Posteriormente se deberán colectar muestras de suero de una muestra estadísticamente significativa de animales sin problemas clínicos dos semanas después de la exposición y medir anticuerpos mediante la técnica de ELISA cuando el ensayo esté disponible, en México no existe una prueba disponible y validada para la medición de anticuerpos frente a PED.
Si algunos animales fallan en evidenciar signos clínicos con los primeros días de exposición, se deberá repetir el proceso, en este mismo sentido el material para exposición requerido puede ser menor en aquellos animales que aún no muestran signos clínicos.
Una vez que se ha corroborado la eficacia del Feedback, es muy importante hacer un desvió de flujo o ventana sanitaria en cerdos al destete para asegurar que no se re-infecten después de que la inmunidad materna haya declinado debajo de un nivel protectivo.
Resumen procedimiento de eliminación
- Confirmación del diagnóstico por parte del laboratorio.
- Día 1: cierre de granja y procurar la mínima o nula introducción de animales de reemplazo los siguientes tres meses.
- Día 1-21: exponer a todos los animales de la granja, incluyendo reemplazos a contenido intestinal de animales con diarrea aguda. La exposición deberá aplicarse de forma inmediata y continua hasta que los animales expuestos desarrollen la enfermedad clínica.
- Después de iniciados los signos clínicos, se deberá utilizar un sistema todo dentro-todo fuera estricto. Se deberá garantizar la limpieza, desinfección y secado de las instalaciones entre cada grupo.
- Treinta días después de que se eliminaron los signos clínicos introducir animales centinelas de una granja negativa y preferiblemente de la misma fuente de la granja, como pueden ser los animales de reemplazo. Si existiera técnica de medición de anticuerpos colectar muestras de suero y verificar el estatus de los animales.
- Observar diariamente a los animales centinelas y registrar la aparición de signos clínicos, en caso de que cursen con diarrea se deberán sacrificar y realizar necropsia en la etapa aguda de la enfermedad y tomar muestras de tejidos para el envío al laboratorio de diagnóstico. Si las muestras analizadas para PED son positivas revisar las prácticas de manejo y reconsiderar una exposición adicional, nuevamente se deberán colectar muestras de suero de los animales centinelas para medir anticuerpos contra PED, en caso de que existan pruebas disponibles.
- Si no se observan signos clínicos en los animales centinelas durante 30 días y la serología indica que nos los animales no han tenido contacto, se puede asumir que el virus ha sido eliminado.
Bioseguridad en granjas
- Establecer protocolos estrictos de acceso de personal a granjas (duchas, cambio de ropa y calzado).
- Limitar el ingreso de personal externo a la granja y especificar tiempos de vacío sanitario.
- Establecer claramente la zona limpia (granja) y la sucia (exterior de la granja). El límite deberá ser la ducha, el cerco perimetral y el área de embarque de los cerdos.
- Los baños deberán mantenerser siempre limpios y desinfectados con soluciones cloradas (SPF Base Clean, SPF 80-50).
- Prohibir el ingreso de objetos personales a la granja.
- Utilizar exclusivamente ropa de trabajo proporcionada en el interior de la granja.
- Desinfectar manos y brazos antes de ingresar a la granja (SPF Body Clean).
- Habilitar caseta de desinfección de material que se requiera ingresar a la granja (SFP 80-50, Tek-Trol). No permita acceso de material sucio.
- Establecer un programa estricto de control de plagas.
- Utilizar y mantener mallas pajareras en todas las naves.
- Aplicar desinfectantes adecuados luego de remover las heces (SPF 11-15, SPF 13-30, SPF 80-50).
- Entrenar a un operario para que haga una estricta verificación de la limpieza de los camiones y jaulas.
- Aplicar un desinfectante en aerosol (Tek-Trol), a la cabina del vehículo, planta de los zapatos del chofer y a los pedales antes de ingresar a la granja a cargar cerdos.
- Exigir constancia de lavado y desinfección y verificar que no existan restos de heces en la superficie de la jaula del camión.
- Limitar el ingreso de camiones sucios. Exigir que se vuelvan a lavar y desinfectar si no cumple con las especificaciones.
- Lavar y desinfectar con máximo detalle la rampa una vez terminada la carga (SPF 13-30; SPF 11-15). Esta puede ser la puerta de entrada del virus a la granja.
- Exigir al chofer el uso de botas desechables si se va a bajar del camión a la periferia de la granja.
- Mantener un único lugar de acopio de mortalidad lo más alejado posible de las naves. Lavar y desinfectar muy bien la superficie si realizó necrospias (SPF 13-30; SPF 11-15).
- Retirarse las botas de trabajo antes de acceder a oficinas, comedores o baños.
- Crear la cultura de lavado y desinfección de las botas antes de terminar la jornadas.
Bioseguridad en el transporte de los cerdos
Poner máxima atención al lavado y desinfección de las unidades que transportan cerdos a rastro y puntos de venta de cerdos vivos. Si entregan cerdos vivos fuera del estado establezca al menos 2 puntos de limpieza y desinfección antes de volver a ingresar a la granja. Utilizar áreas de lavado con infraestructura adecuada (módulo de lavado, área de descanso limpia y sucia, equipos de agua a presión) y personal capacitado.
Se recomienda llevar a cabo el siguiente protocolo de limpieza y desinfección:
- Remueva completamente todo resto de heces de los pisos, jaulas, chasis, correderas de puertas y bajo el camión. Utilizar agua a presión.
- Utilice detergente para remover el biofilm (SPF Base clean). Deje actuar al menos por 20 minutos antes de enjuagar con agua.
- Permita un tiempo de secado de superficies.
- Verifique que no haya ningún resto de heces antes de aplicar el desinfectante.
- Aplicar el desinfectante idóneo sobre todas las superficies (SPF 11-15, SPF 12-10).
- Lave el interior de la cabina removiendo toda suciedad con cepillo, agua y detergente, prestando atención especial a los pedales y tapetes (SPF Base Clean, Tek-Trol).
- Si la operación lo permite, otorgue tiempo de descanso/secado de al menos 12 horas antes de ir a cargar.
- Disponga de una persona entrenada para que verifique y valide el proceso. Deberá emitir una constancia firmada avalando el proceso realizado.
- En rastros, zonas de acopio, puntos de venta de cerdo vivo y en granjas exija al chofer el uso de botas desechables nuevas para bajarse
Precauciones
El proceso de eliminación del virus debe realizarse con mucha disciplina y bajo la dirección de un Médico Veterinario. Especial atención se deberá tener en granjas que son activas al virus de PRRS, en estos casos, se deberá estabilizar primero el sistema antes de la aplicación de Feedback. Con la finalidad de estabilizar de forma rápida los sistemas de producción contra PRRS, se recomienda la aplicación de dos sabanas de inmunoglobulinas de origen aviar específicas para el virus PRRS (InmunoPRRS) en el hato reproductor con diferencia de 15 días.
Bibliografía
Grupo Porcícola Méxicano (16-Agosto-2013). Boletin: Diarrea Epidemica Porcina (PED) Reduzca los riesgos de ingreso.
Harris, H.D.L. (2012). Porcine Epidemic Diarrhea. The Merck Manual. Merck, Sharpe and Dohme Corp.
Kamau, N.A., Park, J.Y., Park, J.E., Hyun, B.H. (2010). Susceptibility of Mice to Porcine Epidemic Diarrhea Virus. Journal of Animal and Veterinary Advances 9, 3114-3116.
Krasny, R. (2013). Virus found in Iowa hog population, possibly beyond. Reuters. Thomson Reuters, Washington, D.C., 1.
Kweon, C.H., Kwon, B.J., Woo, S.R., Kim, J.M., Woo, G.H., Son, D.H., Hur, W., Lee, Y.S. (2000). Immunoprophylactic effect of chicken egg yolk immunoglobulin (Ig Y) against porcine epidemic diarrhea virus (PEDV) in piglets. J Vet Med Sci. 62:961964.
Kocherhans, R., Bridgen, A., Ackermann, M., Tobler, K. (2001). Completion of the porcine epidemic diarrhoea coronavirus (PEDV) genome sequence. Virus Genes 23:137144. doi:10.1023/A:1011831902219.
Li, W., Li, H., Liu, Y., Pan, Y., Deng, F., Song, Y., Tang, X., He, Q. (2012). New variants of porcine epidemic diarrhea virus, China, 2011. Emerging infectious diseases 18, 1350-1353.
Marthaler, D., Jiang, Y., Otterson, T., Goyal, S., Rossow, K., Collins, J. (2013). Complete genome sequence of porcine epidemic diarrhea virus strain USA/Colorado/2013 from the United States. Genome Announc. 1(4):e00555-13. doi:10.1128/genomeA.00555-13.
Park, S.J., Song, D.S., Park, B.K. (2013). Molecular epidemiology and phylogenetic analysis of porcine epidemic diarrhea virus (PED) field isolates in Korea. Archives of virology.
Pensaert, M., de Bouck, P. (1978). A New Coronavirus-like Particle Associted with Diarrhea in Swine. Archives of virology 58, 243-247.
Pospischil, A., Stuedli, A., Kiupel, M. (2002). Diagnostic Notes Update on porcine epidemic diarrhea. J Swine Health Prod 10, 81-85.
ProMed. (2013). Porcine Epidemic Diarrhea-USA (Iowa) First Report. International Society for Infectious Diseases.
Song, D., Park, B. (2012). Porcine epidemic diarrhoea virus: a comprehensive review of molecular epidemiology, diagnosis, and vaccines. Virus genes 44, 167-175.
The American Meat Institute. (2013). The United States Meat Industry at a Glance.
The Center for Food Security and Public Health. (2013). Vaccines : Porcine Epidemic Diarrhea. Iowa State University.
The Pig Site. (2013). USDA Confirms Porcine Epidemic Diarrhoea Virus. The Pig Site.
Turgeon, D.C., Morin, M., Jolette, J., Higgins, R., Marsolais, G., DiFranco, E., 1980. Coronavirus-like particles associated with diarrhea in baby pigs in Quebec. The Canadian veterinary journal. La revue veterinaire canadienne 21, 100-xxiii.
United States Department of Agriculture, 2011. National Animal Health Reporting System Reportable Disease List.
USDA-APHIS-VS-CEAH National Surveillance Unit, 2013. Case definition for porcine epidemic diarrhea. Date accessed: May 21, 2013.
Wood, E.N., 1977. An apparently new syndrome of porcine epidemic diarrhoea. The Veterinary record 100, 243-244.
World Organization for Animal Health, 2013. OIE-Listed diseases, infections and infestations in force in 2013.
Xu, X., Zhang, H., Zhang, Q., Dong, J., Liang, Y., Huang, Y., Liu, H.J., Tong, D., 2013. Porcine epidemic diarrhea virus E protein causes endoplasmic reticulum stress and up-regulates interleukin-8 expression. Virology journal 10, 26.
Yang, X., Huo, J.Y., Chen, L., Zheng, F.M., Chang, H.T., Zhao, J., Wang, X.W., Wang, C.Q., 2013. Genetic variation analysis of reemerging porcine epidemic diarrhea virus prevailing in central China from 2010 to 2011. Virus genes 46, 337-344.
Comentarios (0)


 Español
Español  Inglés
Inglés