Para dejar un comentario Regístrate aquí o si ya tienes una cuenta debes Iniciar sesión

Porcinos
junio 6, 2023
Estrategia integral para el manejo de Actinobacillus pleuropneumoniae en granjas porcinas.
García Valencia D.B.
Introducción
La pleuropneumonía porcina causada por Actinobacillus pleuropneumoniae (App) es una enfermedad contagiosa que se encuentra distribuida en todo el mundo causando importantes pérdidas económicas. Los signos clínicos principales en la fase aguda de la enfermedad son anorexia, depresión, fiebre, tos, disnea y/o polipnea, y a veces vómito.
La enfermedad puede progresar rápidamente y la muerte puede ocurrir en pocas horas. Siendo, en algunos casos, el hallazgo de cerdos muertos el primer indicio de la presencia de App. La enfermedad también puede manifestarse bajo la forma crónica, donde los signos clínicos son menos evidentes, pero las pérdidas de producción y las lesiones al rastro (adherencias, pleuritis y abscesos pulmonares) son comúnmente observadas. En muchas explotaciones el App está presente en forma subclínica. Esto ocurre de manera frecuente en granjas convencionales afectadas no sólo con diferentes serotipos de baja virulencia, sino también con serotipos de alta virulencia. En este último caso, pueden surgir brotes en la presencia de enfermedades concomitantes o como consecuencia de cambios de manejo en la piara. Por consiguiente, la identificación temprana de granjas infectadas de forma subclínica es crucial para el control de las enfermedad donde los animales portadores son una de las fuentes principales de transmisión entre los animales.
Etiología
App es un microorganismo Gram negativo, perteneciente a la familia Pasteurellaceae, de morfología bacilar y anaerobios facultativos. Es un cocobacilo pleomórfico, capsulado y no esporulado, puede manifestar formas filamentosas cuando las condiciones de crecimiento no son las óptimas. Tradicionalmente ha sido considerado inmóvil, aunque recientemente se ha demostrado la existencia de flagelos y la movilidad consiguiente. En aislamientos iniciales requiere una atmósfera con un 5% de CO2. Su crecimiento es dependiente del factor V de coagulación de la sangre (NAD, dinucleótido, de nicotinamida y adenina). Hasta el momento se han descrito 15 serotipos de acuerdo a la composición del polisacárido, es hemolítico, con distintos matices en función del serotipo. Además, debidamente inoculado frente a S. aureus, produce una zona de hemólisis completa.
Patogenia
La infección usualmente ocurre a través de la vía aérea o por contacto directo. El microorganismo es capaz de colonizar las tonsilas y adherirse al epitelio alveolar. En general, el paso inicial para la colonización bacteriana lo constituye la adherencia a las células del huésped. Se ha demostrado que App es capaz de unirse in vitro a fosfolípidos, los cuales representan el principal componente de las membranas celulares. El antígeno O del LPS está implicado en tal adherencia ya que anticuerpos monoclonales dirigidos contra ese antígeno, inhiben tal unión (Jeannotte et al, 2003). Se ha demostraron que A. pleuropneumoniae tiene la capacidad de formar biofilms o biopelículas en medio de cultivo sólido, propiedad que pierde después de uno o dos pasajes in vitro. La propiedad fenotípica de formar biopelículas pudiera ser un factor importante para la colonización, virulencia y transmisión del agente. Las bacterias en el biofilm son rodeadas por una matriz sintetizada por ellas mismas que mantiene las células agrupadas en una masa y las adhiere firmemente a las superficies subyacentes. Dicha matriz es de naturaleza polisacárida (Costerton et al., 1999). Esta matriz aparte de garantizar un microambiente protegido a las células, contiene nutrientes disueltos y enzimas secretadas, pudiendo ser responsable de la resistencia a ciertos antibióticos así como también a las defensas del hospedador. App también es capaz de adherirse a las células bucales epiteliales lo cual puede ser un factor importante en la existencia de cerdos portadores sanos. La presencia de fimbrias también debe jugar un papel en la adherencia de la bacteria a las superficies mucosas.
Bajo ciertas circunstancias la bacteria puede llegar al pulmón en donde es fagocitada rápidamente por los macrófagos alveolares. Cuando la concentración de bacterias que alcanza el pulmón es muy elevada, supera la capacidad fagocítica de los macrófagos, observándose bacterias adheridas a la superficie de las células fagocíticas desde donde comienza la secreción de las toxinas Apx I, Apx II, Apx III y/o Apx IV. Dichas toxinas poseen efecto tóxico sobre los macrófagos alveolares, células endoteliales, células epiteliales alveolares, siendo la Apx III de particular efecto tóxico contra macrófagos alveolares.
Las cepas de mayor virulencia tienen la capacidad de producir una mayor cantidad de capsula la cual previene la fagocitosis. La presencia de LPS activa la elaboración de citoquinas que contribuyen al daño tisular asociado con la infección pulmonar.
 Las infecciones concomitantes con agentes como el virus del PRRS y/o Mycoplasma hyopneumoniae contribuyen a un cuadro clínico más severo. Las lesiones necróticas y hemorrágicas a nivel pulmonar pueden ser evidentes de 3 a 5 horas post infección, con presencia de congestión y edema a nivel de la pared alveolar.
Las infecciones concomitantes con agentes como el virus del PRRS y/o Mycoplasma hyopneumoniae contribuyen a un cuadro clínico más severo. Las lesiones necróticas y hemorrágicas a nivel pulmonar pueden ser evidentes de 3 a 5 horas post infección, con presencia de congestión y edema a nivel de la pared alveolar.
Hay acumulación de neutrófilos, acumulación de fibrina, presencia de trombosis e infartos. En casos de bacteriemia el cuadro clínico se hace mucho más severo y puede presentarse muerte sobreaguda. A medida que pasan los días se produce muerte de macrófagos y neutrófilos que se acumulan en la lesión y a nivel de los bronquios. A medida que la lesión evoluciona se hace necrótica y comienza un proceso de fibrosis que conduce a la cicatrización. La infección genera la producción de anticuerpos dirigidos contra cada uno de los factores de virulencia bacteriana. Esos anticuerpos son evidentes a partir de los 10 días post infección.
Mecanismo de transmisión
Cerdos portadores sanos o portadores crónicos juegan un papel crucial en la epidemiología de la enfermedad y representan la principal fuente de infección de cerdos susceptibles (Sebunya y Saunders, 1983). El contacto directo nariz con nariz constituye el modo más importante de transmisión de la infección.
El modo de transmisión aéreo no parece ser una manera común de contagio. Torremorell et al., (1997), demostraron que la transmisión aérea era posible a un metro de distancia. Sin embargo Kristensen et al., (2004), no fueron capaces de demostrar transmisión a esa distancia cuando menos del 10% del aire era transferido de un área contaminada a un área libre del patógeno, simulando lo que normalmente ocurre bajo condiciones naturales. La transmisión de A. pleuropneumoniae a través de vehículos contaminados fue demostrada por Fussing et al., (1998).
Factores predisponentes
Por lo general la infección por A. pleuropneumoniae es subclínica hasta que una situación de stress, resulta en la aparición de brotes. Cambios climáticos bruscos con frecuencia representan el factor predisponente de los brotes (Rosendal et al., 1985). La severidad de la enfermedad está correlacionada con el nivel de inmunidad del hato afectado.
Brotes de la enfermedad han estado asociados con hacinamiento, pobres condiciones sanitarias, sistemas de producción de flujo continuo, pobre ventilación, humedad elevada y variaciones extremas de temperatura a lo largo del día (Pijoan et al., 1983).
El papel de la inmunidad en el control de APP
La inmunidad de las madres juega un rol crítico en la epidemiología de la enfermedad. La duración de la inmunidad pasiva oscila entre 2 a 8 semanas, dependiendo principalmente del nivel de anticuerpos obtenidos a partir de la madre (Vigre et al., 2003). Una reducción significativa de la prevalencia de lesiones a nivel de rastro ha sido demostrada a consecuencia de la aplicación de un programa de vacunación del hato (Utrera et al., 2000).

La erradicación de la enfermedad ha sido posible con la aplicación de técnicas de medicación y despoblación así como también el manejo todo dentro todo fuera (Desrosiers, 2004).
Uno de los elementos claves que determinan la evolución de la enfermedad en los hatos afectados, lo constituye la inmunidad contra el agente causal. Una vez que un animal se recupera de la infección, adquiere protección contra el desafío por todos los serotipos de A. pleuropneumoniae.
La presencia de inmunidad pasiva es un factor importante que se ha demostrado que interfiere en la inmunidad activa de los lechones. Una típica respuesta inmune primaria sólo es evidente en lechones que no poseen anticuerpos de origen materno al momento de ser desafiados.
La vacunación de las madres ha demostrado poseer un efecto positivo en la estabilización de la inmunidad del rebaño y en reducir la incidencia del problema en cerdos destetados (Utrera et al., 2000). La inmunidad pasiva posee un efecto protector contra la infección por A. pleuropneumoniae. La duración de la inmunidad pasiva varía entre 2 a 8 semanas dependiendo del nivel de anticuerpos adquiridos (Vigre et al., 2003).
Inmunoterapia
La producción de inmunoglobulina Y en huevos de gallinas ha sido reportado como una alternativa para el control de los signos y lesiones asociados a la infección (Shin et al., 2002). Dichos investigadores fueron capaces de prevenir la enfermedad en cerdos que consumieron yema de huevo inmune frente a A. pleuropneumoniae.
Soluciones de control integral IASA
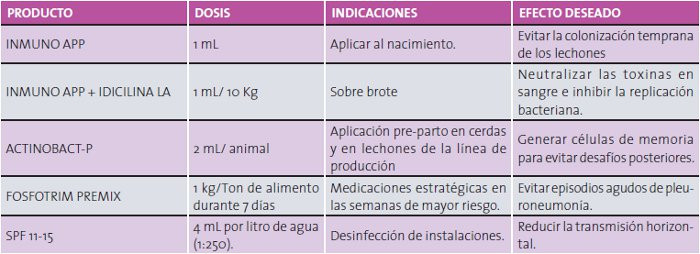
En Investigación Aplicada SA de CV se cuentan con las herramientas necesarias para el control integral de la pleuropneumonía porcina, dichas herramientas consideran el uso de anticuerpos de origen aviar específicos para el control de Actinobacillus pleuropneumoniae (INMUNOAPP) en las primeras horas de vida del animal con la finalidad de evitar la colonización temprana con App. La vacunación de las cerdas del pie de cría con ACTINOBACT-P en programa pre-parto es una excelente forma de proteger a los lechones, dado que la principal fuente de transmisión de agentes infecciosos para los lechones es su madre, pero también es una vital fuente de inmunidad. Las cerdas desarrollan inmunidad activa al ser expuestas a los agentes infecciosos y luego transfieren a los lechones la inmunidad pasiva o maternal, constituida principalmente por anticuerpos, los cuales tienen una vida media determinada.
Una vez en el destete, algunos lechones que se infectaron de sus madres comenzarán a excretar microorganismos, otros estarán inmunes por contar aún con inmunidad pasiva que les permitirá defenderse de la infección, pero otro grupo de individuos estará susceptible, bien sea porque no recibió inmunidad maternal de su madre o porque los anticuerpos ya disminuyeron. En este momento es cuando una infección determinada puede generar enfermedad o simplemente pasar desapercibida, dependiendo de la proporción de individuos infecciosos, susceptibles e inmunes en el grupo, de acuerdo a lo anterior recomendamos el uso de una bacterina inactivada para el control de App (ACTINOABCT-P) con base en la medición del catabolismo de anticuerpos de origen materno.
Dentro de las estrategias complementarias que se utilizan para prevenir y/o controlar la presencia de A pleuropneumoniae se encuentra la utilización de antimicrobianos. Una gran variedad de antimicrobianos son utilizados como penicilina, tetraciclina, estreptomicina, sulfacloropiridacina + trimetropim, lincomicina entre otros. Sin embargo, debido a que A. pleuropneumoniae juegan un papel importante dentro de las enfermedades respiratorias de los cerdos y cada día se utilizan más antimicrobianos de forma indiscriminada e inadecuada, como herramienta para el combate del complejo respiratorio, ES NECESARIO conocer la sensibilidad de A. pleuropneumoniae para determinar qué antibiótico utilizar, en estudios realizados en el laboratorio de biología de Investigación Aplicada SA de CV, se ha determinado una amplia sensibilidad a la Fosfomicina (FOSFOTRIM), razón que lo ubica a dicho antibiótico entre las primeras opciones de tratamiento para el control de App; adicionalmente el uso de inmunoglobulinas de origen aviar más la combinación de un antibiótico de larga acción (INMUNOAPP + IDICILINA LA) han demostrado neutralizar la infección y frenar la diseminación en brotes de enfermedad aguda, con la ventaja de un efecto sinérgico, contundente y de óptimos resultados.
En todo proceso infeccioso dentro de una explotación pecuaria es recomendable establecer o ajustar las medidas de bioseguridad, entre ellas se deberán considerar siempre las prácticas de limpieza y desinfección, en las poblaciones porcinas se ha descrito que el App es altamente sensible a formaldehido, glutaraldehído, etanol, isopropileno y clorhexidina, en ausencia de materia orgánica. Estudios in vitro e in vivo han demostrado que la formulación de cuaternarios de amonio y glutaraldehído (SPF 11-15 FARM) tiene un excelente desempeño en la eliminación del microorganismo en el ambiente, evitando de esa forma la diseminación del microorganismo en las granjas porcinas.
Referencias Bibliográficas
Costerton, J.W., Stewart, P.S., Greenberg, E.P. (1999). Bacterial biofilms: a common cause of persistent infections. Science 284:1318-1322.
Desrosiers, R. (2004). Epidemiology, diagnosis and control of swine diseases. Proceeding American Association Swine Veterinarians 2004. pp 9-38.
Fussing, V., Barfod, K., Nielsen, R., Moller, K., Nielsen, J.P., Wegener, H.C., Bisgaard, M. (1998). Evaluation and application of ribotyping for epidemiological studies of Actinobacillus pleuropneumoniae in Denmark. Vet Microbiol. 62(2):145-162.
Jeannotte, M.E., Abul-Milh, M., Dubreuil, J.D., Jacques, M. (2003). Binding of Actinobacillus pleuropneumoniae to phosphatidylethanolamine. Infect Immun. 71(8):4657-4663.
Kristensen, C.S., Andreasen, M., Ersboll, A.K., Nielsen, J.P. (2004). Antibody response in sows and piglets following vaccination against Mycoplasma hyopneumoniae, toxigenic Pasteurella multocida, and Actinobacillus pleuropneumoniae. Can J Vet Res. 68 (1):66-70.
Pijoan, C., Morrison, R.B., Hilley, H.D. (1983): Dilution Technique for Isolation of Haemophilus from Swine Lungs Collected at Slaughter. J Clin Microbiol 18(1):143- 145.
Rosendal, S.; Boyd, D.A., Gilbride, K.A. (1985). Comparative virulence of porcine Haemophilus bacteria. Can J Comp Med. 49(1): 68-74.
Sebunya, T.N., Saunders, J.R. (1983). Haemophilus pleuropneumoniae infection in swine: a review. J Am Vet Med Assoc. 182(12): 1331-1337
Shin, N.R., Choi, I.S., Kim, J.M., Hur, W., Yoo, H.S. (2002). Effective methods for the production of immunoglobulin Y using immunogens of Bordetella bronchiseptica, Pasteurella multocida and Actinobacillus pleuropneumoniae. J Vet Sci. 3(1):47-57.
Torremorell, M., Pijoan, C., Janni, K., Walker, R., Joo, H.S. (1997). Airborne transmission of Actinobacillus pleuropneumoniae and porcine reproductive and respiratory syndrome virus in nursery pigs. Am J Vet Res. 58(8):828-32.
Utrera, V., Pijoan, C.; Villalobos, J.; Rausseo, L.; Lopez, H.; Fuentes, D.; Bordones, A.; Cano, J. (2000). Field trial to evaluate the efficacy o fan autogenous vaccine against Actinobacillus pleuropneumoniae containing whole cell and Apx I toxoid. Proc. 16th IPVS Congress. Melbourne, Australia. 2000. p. 66.
Vigre, H., Ersboll, A.K., Sorensen,V. (2003). Decay of acquired colostral antibodies to Actinobacillus pleuropneumoniae in pigs. J Vet Med B Infect Dis Vet Public Health. 50(9):430-435.
Este Artículo, también se encuentra publicado en la edición No. 93 Mayo - Junio 2013 de la revista Los Porcicultores y su Entorno.
Comentarios (0)


 Español
Español  Inglés
Inglés