Para dejar un comentario Regístrate aquí o si ya tienes una cuenta debes Iniciar sesión

Aves
noviembre 14, 2025
Genotipo V del virus de Enfermedad de Newcastle, avances en protección.
MVZ. David Muñoz
La Enfermedad de Newcastle (ENC) es una enfermedad viral altamente contagiosa de las aves causada por el Virus de la Enfermedad de Newcastle (VEN). El virus de la enfermedad de Newcastle (VEN) es un virus de ARN de cadena sencilla y sentido negativo, perteneciente a la familia Paramyxoviridae y al género Orthoavulavirus aviar 1. Es el agente causal de una de las enfermedades más importantes de las aves domésticas y silvestres a nivel mundial, conocida por provocar signos respiratorios, digestivos y neurológicos, así como altas tasas de mortalidad (90-100%) en brotes severos. En los últimos años la investigación ha mostrado que el genotipo V de éste virus sigue presente en los brotes de aves de corral y silvestres en México. (1)
El virus presenta partículas esféricas o filamentosas, con un tamaño que varía entre 100 y 250 nanómetros de diámetro. Su envoltura contiene dos proteínas de superficie fundamentales: La hemaglutinina-neuraminidasa (HN), responsable de la unión del virus a las células del ave y la proteína de fusión (F), que permite la entrada del virus a las células (figura 1)).
Las proteínas de superficie no solo determinan la capacidad del virus para infectar, sino también su capacidad patógena (virulencia). Cuando el sitio de corte de la proteína F contiene múltiples aminoácidos básicos, el virus se vuelve capaz de replicarse en diversos tejidos del ave, provocando formas más graves de la enfermedad.
El VEN afecta principalmente a pollos, pavos, palomas, patos y aves silvestres, y se transmite por contacto directo con secreciones respiratorias o excretas contaminadas. Genera alta morbilidad e impacto económico, y es una enfermedad de notificación obligatoria ante la Organización Mundial de Sanidad Animal (OMSA). (2)
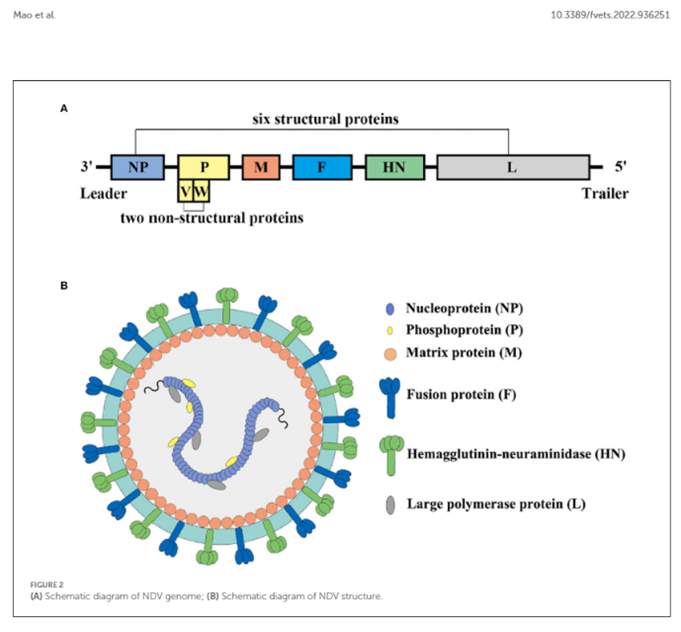
Figura 1. Diagrama esquemático del genoma del VEN (Mao Et al 2022).
Presentaciones clínicas y patotipos.
Los VEN se clasifican en tres categorías prácticas según su patogenicidad en aves:
- Lentogénico (baja virulencia): síntomas leves o asintomáticos; afecta a aves jóvenes con baja producción; en ocasiones se presentan únicamente signos respiratorios leves.
- Mesogénico (virulencia intermedia): signos respiratorios más evidentes, caída en producción, algunas mortalidades moderadas (5-20%).
- Velogénico (alta virulencia): enfermedad sistémica severa, alta mortalidad (90-100%), signos respiratorios, digestivos y neurológicos (tortícolis, parálisis).
-
La velogenicidad se asocia molecularmente con el sitio de corte de la proteína F del virus; los virus con un sitio de corte polibásico son capaces de activarse por proteasas intracelulares, favoreciendo la diseminación e infección y causando enfermedad sistémica. (1) En la figura 2 podemos observar algunos signos clínicos.
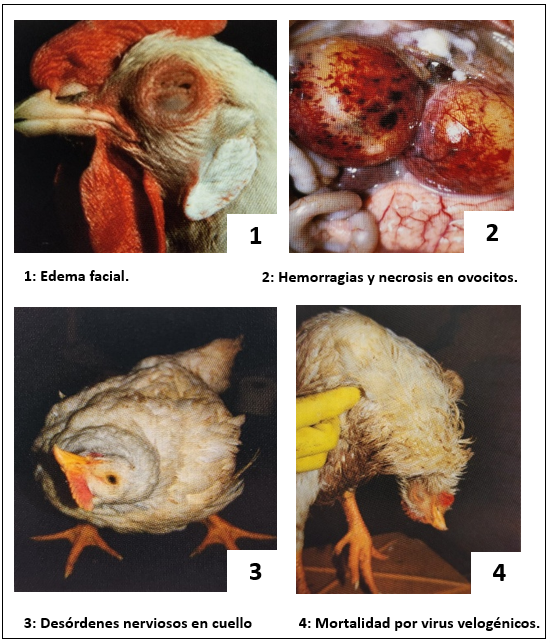
Figura 2. Signos clínicos de ENC. (Brugére et Al.2015).
¿El VEN Genotipo V en México es nuevo?
Estudios filogenéticos reportados muestran que virus velogénicos pertenecientes al genotipo V de la clase II han circulado y evolucionado en México durante décadas (desde 1996 en gallinas), los virus del genotipo V han evolucionado en granjas comerciales y aves de traspatio generando subgrupos, a pesar de las campañas de vacunación con vacunas derivadas de genotipo II (LaSota). En años recientes la literatura continúa reportando la presencia de genotipo V como causante de brotes en la región. (1) (Figura 3)
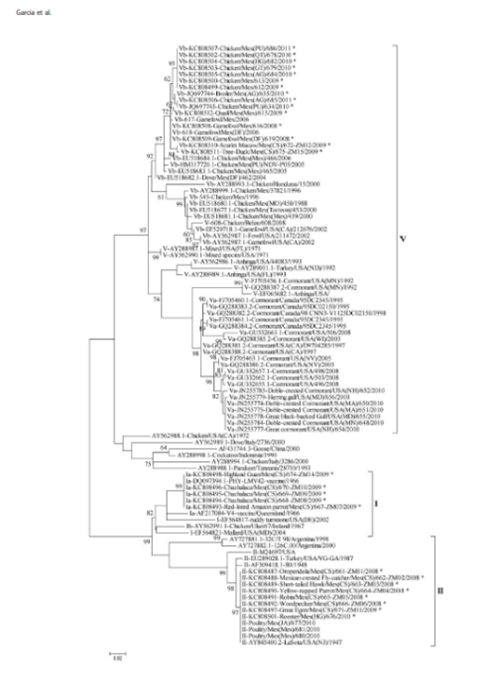
Figura 3. Análisis filogenético de virus de ENC genotipos I, II y V en América (García Et Al 2013).
Actualidades en clasificación y prevalencia de Genotipo V de VEN en México.
En el año 2019, Kiril M. Dimitrov confirmó la presencia del virus de Newcastle clase II genotipo V en América, principalmente en EE. UU, Nicaragua, Honduras y México. Además, propuso una reclasificación de éste genotipo, colocando a Va como un nuevo genotipo independiente (XIX), debido a que estaba suficientemente distante de los demás. En el mismo estudio los subgenotipos Vb y Vc fueron confirmados y renombrados como V.1 (antiguo Vb) y V.2 (antiguo Vc). Los subgenotipos V.1 y V.2 se han detectado en México. (3) (figura 4).
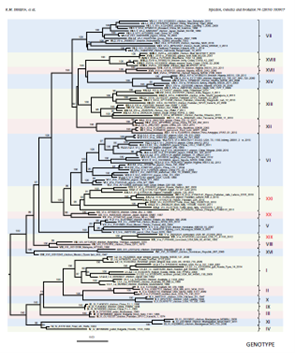
Figura 4. Análisis filogenético y nueva clasificación de diferentes genotipos de VEN a nivel mundial. (K.M. Dimitrov, et al 2019).
Presión selectiva y deriva antigénica.
El VEN tiene un genoma ARN en sentido negativo y su polimerasa comete errores (mutaciones) que generan diversidad genética en cada infección (5).
Cuando hay un ambiente desafiante para el virus (por ejemplo, aves vacunadas y medidas de bioseguridad), solo los virus con mutaciones que les faciliten evadir la inmunidad, diseminarse o persistir sobreviven mejor. Un ejemplo de ello lo muestra un estudio realizado en China en 2020, en el que los investigadores analizaron el genoma del VEN genotipo VII. Encontraron 6 mutaciones en el gen de la proteína F que no aparecieron al azar, sino que parecían ayudar al virus a evadir la inmunidad generada por las vacunas (presión selectiva) y adaptarse mejor al huésped. (6)
La deriva antigénica es un fenómeno por el cual pequeñas mutaciones se acumulan en los genes que codifican antígenos, normalmente proteínas de superficie del virus (F y HN) y como resultado el virus puede escapar parcialmente de la respuesta inmune generada previamente por vacunación. (7).
Vacunación y los límites de la protección cruzada entre diferentes genotipos de VEN.
La vacunación contra Newcastle en México se encuentra autorizada desde 1994. Las vacunas disponibles en México son vacunas emulsionadas y vacunas activas que pueden contener virus LaSota, Clone-30, B1 o vacuna recombinante basada en La Sota que expresa las proteínas F y HN de Genotipo V. (10)
Aunque el virus de la enfermedad de Newcastle pertenece a un solo serotipo, sus diferentes genotipos (más de veinte reconocidos hasta hoy) presentan variaciones genéticas que pueden afectar el grado de protección que ofrecen las vacunas tradicionales, como LaSota (genotipo II) contra desafíos heterólogos como los que podrían presentarse en México con el Genotipo V.
En teoría, todas las vacunas deberían proteger contra cualquier cepa, pero en la práctica, las diferencias acumuladas en las proteínas de superficie del virus, particularmente en F y HN, pueden limitar esa protección cruzada. Esto significa que, aunque las aves vacunadas sobrevivan a la infección, aún pueden eliminar el virus y contribuir a su diseminación.
Un estudio reciente realizado en Egipto (Abdel-Rahman et al., 2025) analizó cepas de Newcastle del genotipo VII.1.1 circulantes en granjas avícolas y encontró mutaciones en los epítopos de las proteínas F y HN, las cuales redujeron la reactividad frente a anticuerpos generados por la vacuna LaSota, basada en genotipo II. Los investigadores observaron que, aunque las aves vacunadas no morían, la inmunidad inducida no evitaba la replicación ni la excreción viral, lo que favorece la persistencia del virus en campo.
Este fenómeno, conocido como escape inmunitario, es una forma de adaptación del virus frente a la presión vacunal.
Desarrollo de vacunas recombinantes.
En el año 2019 Ray Izquierdo-Lara y colaboradores publicaron una investigación en la cual
desarrollaron dos virus recombinantes basados en la vacuna LaSota (genotipo II), pero modificados para portar las proteínas F y HN del genotipo XII, el cual circula activamente en Sudamérica.
El objetivo era evaluar si una vacuna “emparejada” genéticamente con la cepa de campo podía ofrecer una protección más completa que la vacuna tradicional heteróloga. (8)
Los resultados fueron reveladores:
aunque la vacuna LaSota clásica protegió a las aves frente a la mortalidad, no evitó que siguieran excretando el virus después del desafío con la cepa del genotipo XII. En cambio, el virus recombinante genotipo XII proporcionó una inmunidad más eficaz contra el desafío homólogo, reduciendo drásticamente la eliminación viral y, por tanto, el riesgo de transmisión a otras aves.
Además, los autores descubrieron que para lograr esta eficacia era esencial conservar las colas citoplasmáticas originales de las proteínas F y HN, ya que estas influyen en la capacidad del virus vacunal para replicarse y estimular adecuadamente al sistema inmune.
Aunque las aves vacunadas con LaSota generalmente no mueren, sí pueden actuar como portadoras subclínicas, diseminando el virus en la granja y dificultando su erradicación. (8)
El papel de la bioseguridad en el control de ENC.
El control de la enfermedad de Newcastle no depende únicamente de la vacunación.
Aun cuando se utilicen vacunas eficaces, la bioseguridad sigue siendo el pilar más importante para evitar la entrada y propagación del virus en las granjas.
Esto se debe a que el virus de Newcastle es altamente contagioso, capaz de transmitirse por el aire, el agua, los alimentos, el equipo contaminado e incluso por el calzado o la ropa del personal (9).
Diversos estudios han demostrado que las medidas básicas de bioseguridad, como la restricción de visitas, el control del ingreso de vehículos, la limpieza y desinfección regular, el manejo adecuado de la mortalidad, y la separación por edades o lotes, reducen significativamente el riesgo de brotes, incluso en regiones donde el virus es endémico.
Uno de los estudios más representativos sobre este tema es el de Dimitrov et al. (2016), publicado en Avian Diseases, donde se analizaron brotes recientes en América Latina, África y Asia.
Los autores concluyeron que, en la mayoría de los casos, las fallas en bioseguridad como la introducción de aves sin cuarentena, el uso de agua contaminada o la presencia de aves silvestres, fueron factores determinantes en la aparición de nuevos brotes, incluso en aves correctamente vacunadas. Este trabajo resalta que la vacunación no sustituye las buenas prácticas de manejo, sino que debe integrarse dentro de un programa integral de bioseguridad.
Conclusiones.
La Enfermedad de Newcastle continúa siendo una de las principales amenazas sanitarias para la avicultura mundial, no solo por su capacidad de causar alta mortalidad, sino por la complejidad de su control en regiones donde el virus se ha vuelto endémico. Aunque pertenece a un solo serotipo, la gran diversidad genética entre sus genotipos ha demostrado influir en la eficacia de las vacunas y en la persistencia de la enfermedad en campo.
A lo largo de los últimos años, las investigaciones como las de Izquierdo-Lara et al. (2019) y Abdel-Rahman et al. (2025), han aportado evidencia sólida de que la protección cruzada entre genotipos no siempre es suficiente. Las vacunas clásicas basadas en el genotipo II (como LaSota o B1) siguen siendo efectivas para evitar la mortalidad, pero no garantizan una protección completa contra la replicación y excreción viral, especialmente frente a genotipos genéticamente distantes, como el V, VII o XII.
La deriva antigénica y la presión selectiva ejercida por el uso continuo de vacunas heterólogas favorecen la aparición de variantes con mutaciones en las proteínas F y HN, las cuales pueden modificar los epítopos reconocidos por los anticuerpos. Estos cambios, conocidos como escapes inmunitarios, son un recordatorio de que la vacunación debe acompañarse de una vigilancia molecular constante y, de ser necesario, la actualización periódica de las cepas vacunales hacia formulaciones genotipo-emparejadas o recombinantes, más adaptadas a las condiciones locales. En conjunto con los protocolos de vacunación, nunca deben descuidarse las medidas de bioseguridad. Los estudios de Dimitrov et al. (2016) y múltiples reportes internacionales han demostrado que los brotes más severos ocurren donde existen fallas de manejo, ingreso no controlado de aves, deficiente desinfección o contacto con aves silvestres. Por tanto, la bioseguridad y la vacunación deben considerarse dos pilares complementarios del control sanitario.
Bibliografía:
- Cardenas Garcia S, Navarro Lopez R, Morales R, Olvera MA, Marquez MA, Merino R, Miller PJ, Afonso CL. 2013. Molecular Epidemiology of Newcastle Disease in Mexico and the Potential Spillover of Viruses from Poultry into Wild Bird Species. Appl Environ Microbiol 79: 2013.
- Mao Qian , Ma Shengming , Schrickel Philip Luke , Zhao Pengwei , Wang Jingya, Zhang Yuhua , Li Shuangyu , Wang Chengbao. Title: Review detection of Newcastle disease virus. DOI=10.3389/fvets.2022.936251. Volume 9 – 2022.
- Kiril M. Dimitrov, Celia Abolnik, Claudio L. Afonso, Emmanuel Albina, Justin Bahl, Mikael Berg, Francois-Xavier Briand, Ian H. Brown, Kang-Seuk Choi, Ilya Chvala, Diego G. Diel, Peter A. Durr, Helena L. Ferreira, Alice Fusaro, Patricia Gil, Gabriela V. Goujgoulova, Christian Grund, Joseph T. Hicks, Tony M. Joannis, Mia Kim Torchetti, Sergey Kolosov, Bénédicte Lambrecht, Nicola S. Lewis, Haijin Liu, Hualei Liu, Sam McCullough, Patti J. Miller, Isabella Monne, Claude P. Muller, Muhammad Munir, Dilmara Reischak, Mahmoud Sabra, Siba K. Samal, Renata Servan de Almeida, Ismaila Shittu, Chantal J. Snoeck, David L. Suarez, Steven Van Borm, Zhiliang Wang, Frank Y.K. Wong,
Updated unified phylogenetic classification system and revised nomenclature for Newcastle disease virus, Infection, Genetics and Evolution, Volume 74, 2019,103917, ISSN 1567-1348, doi.org/10.1016/j.meegid.2019.103917. 2019
- Mihiretu, B.D., Usui, T., Chibssa, T.R. et al. Whole-genome characterization of Newcastle disease virus isolates of sub-genotype VII.1.1 from chickens in Ethiopia. Virus Genes (2025). doi.org/10.1007/s11262-025-02195-7. 2025
- Jadhav, A., Zhao, L., Liu, W., Ding, C., Nair, V., Ramos-Onsins, S. E., & Ferretti, L. (2020). Genomic Diversity and Evolution of Quasispecies in Newcastle Disease Virus Infections. Viruses, 12(11), 1305. https://doi.org/10.3390/v12111305 2020
- Xiang, B., Chen, L., Cai, J., Liang, J., Lin, Q., Xu, C., Ding, C., Liao, M., & Ren, T. (2020). Insights into Genomic Epidemiology, Evolution, and Transmission Dynamics of Genotype VII of Class II Newcastle Disease Virus in China. Pathogens (Basel, Switzerland), 9(10), 837. https://doi.org/10.3390/pathogens9100837 2020
- Zhengwu Chang, Xiaoyu Dong, Zhao Guan, Kejia Lu, Xi Chen, Xi Wei, Hanwei Guo, Ruyi Dang, Juan Wang, Xinglong Wang, Sa Xiao, Zengqi Yang, Haijin Liu, Variación antigénica en la hemaglutinina-neuraminidasa del virus de la enfermedad de Newcastle aislado en el Tíbet, China. Microbiología veterinaria,Volumen 285,2023, 109872,ISSN 0378-1135, doi.org/10.1016/j.vetmic.2023.109872. 2023
- Ray Izquierdo-Lara ,Ana Chumbe,Katherine Calderón,Manolo Fernández-Díaz,Vikram N. Vakharia Genotype-matched Newcastle disease virus vaccine confers improved protection against genotype XII challenge: The importance of cytoplasmic tails in viral replication and vaccine design. https://doi.org/10.1371/journal.pone.0209539 2019.
- Department of Clinical Sciences, College of Veterinary Medicine, King Faisal University, Al Hofuf, Saudi Arabia Avian Research Center, King Faisal University, Al Hofuf, Saudi Arabia. A review of current knowledge on avian Newcastle infection in commercial poultry in the Kingdom of Saudi Arabia. DOI: 10.5455/OVJ.2024.v14.i1.2. 2023.
- Absalón, A.E., Cortés-Espinosa, D.V., Lucio, E. et al. Epidemiology, control, and prevention of Newcastle disease in endemic regions: Latin America. Trop Anim Health Prod 51, 1033–1048 (2019). https://doi.org/10.1007/s11250-019-01843-z 2019
Comentarios (0)


 Español
Español  Inglés
Inglés 
