Para dejar un comentario Regístrate aquí o si ya tienes una cuenta debes Iniciar sesión

Aves
noviembre 26, 2020
Enfermedad de Newcastle: actualidades en su clasificación
MVZ. Esp. Alberto Guadarrama Jiménez.
La Enfermedad de Newcastle (ENC) es causada por un virus de la familia Paramyxoviridae. El virus de la Enfermedad de Newcastle es envuelto, pleomórfico con un diámetro de 200 a 300 nm, su genoma es no segmentado en sentido negativo de cadena sencilla de RNA. El Comité internacional de taxonomía viral ha creado en 2019, tres géneros: Orthoavulavirus, Metaavulavirus y Paraavulavirus dentro de una nueva subfamilia (Avulavirinae) de la familia Paramyxoviridae. Los virus del género Avian orthoavulavirus 1 (AOAV-1) antes designados como Avian avulavirus 1 (AAvV-1), conocidos comúnmente como Avian paramyxoviruses 1 (APMV-1). Los virus de la enfermedad de Newcastle son causantes de infecciones en una amplia variedad de aves domésticas y silvestres a nivel mundial.
El virus de la Enfermedad de Newcastle afecta alrededor de 250 especies de aves y se manifiesta con signos clínicos de tipo respiratorio, gastrointestinal o nervioso. La forma más severa de la enfermedad puede producir hasta un 90% de mortalidad en parvadas de aves susceptibles.2 Las cepas virulentas son definidas por la Organización Internacional de Sanidad Animal (OIE) como virus que tienen un índice de patogenicidad intracerebral de 0.7 o superior (2.0 como máximo) o un sitio de corte con múltiples aminoácidos básicos y una fenilalanina en la posición 117. En los últimos cinco años la enfermedad de Newcastle tuvo un impacto global, afectando entre 109 y 200 países pertenecientes a la OIE.3
La amplia circulación del virus de la Enfermedad de Newcastle (NDV) dentro de las poblaciones aviares ha llevado al desarrollo de una amplia diversidad genética y a un constante surgimiento de cepas variantes. Debido a la importancia clínica y económica de la enfermedad de Newcastle en la industria avícola y el constante y difundido uso de vacunas activas alrededor del mundo, para la caracterización de las cepas que circulan en el campo la secuenciación genética y el análisis filogenético han llegado a ser los métodos de elección.
A lo largo de los años, se han desarrollado varios sistemas de clasificación molecular para conocer la evolución y la diversidad genética del virus. A finales de los años 80´s, dos estudios similares basados en el análisis de los genes de la proteína de fusión (F) y la hemoaglutinina-neuraminidasa (HN), propusieron la existencia de tres linajes nombrados A, B y C4.
Actualmente y basado en características genéticas se han propuesto varios sistemas de clasificación de los Paramixovirus aviares tipo 1 (Avian paramyxoviruses 1), el virus de la Enfermedad de Newcastle ha sido clasificado en dos clases I y II. Los virus de la clase I son comúnmente de baja virulencia, han sido aislados predominantemente de aves silvestres y son raramente reportados en especies avícolas productivas. Sólo unos cuantos aislamientos de baja virulencia de virus de la clase I genotipo I han sido reportados en Colombia (KJ865697.1, KJ865703.1, KJ865704.1, KJ865705.1, KJ865711.1) y México (KC808493.1, KC808494.1) entre los años 2009 y 2010. Todas las cepas del virus de la Enfermedad de Newcastle de baja virulencia son negativas cuando se corren por medio de la prueba de PCR de proteína de fusión para determinar la virulencia del virus5.
Las formas virulentas de los virus de la clase II son frecuentemente reportadas en aves productivas, sin embargo, la propagación en aves silvestre ha ocurrido6. Además, genotipos virulentos específicos se mantienen en aves silvestres, como palomas y cormoranes (genotipo VI)7.
A diferencia de la clase I, en la clase II encontramos mayor diversidad de cepas que van desde no virulentas hasta virulentas y un análisis molecular completo identificó 21 distintos genotipos I a XXI, posteriormente el genotipo XV que contenía sólo secuencias recombinantes fue excluido de un análisis final, quedando únicamente 20 genotipos. Los virus previamente clasificados como miembros del sub-genotipo Va fueron separados dentro de un nuevo genotipo XIX. Virus previamente clasificados como cinco del sub-genotipo del genotipo VI, también formaron dos nuevos genotipos llamados XX y XXI. La distancia evolutiva entre los diversos genotipos se presenta en la tabla 1.8
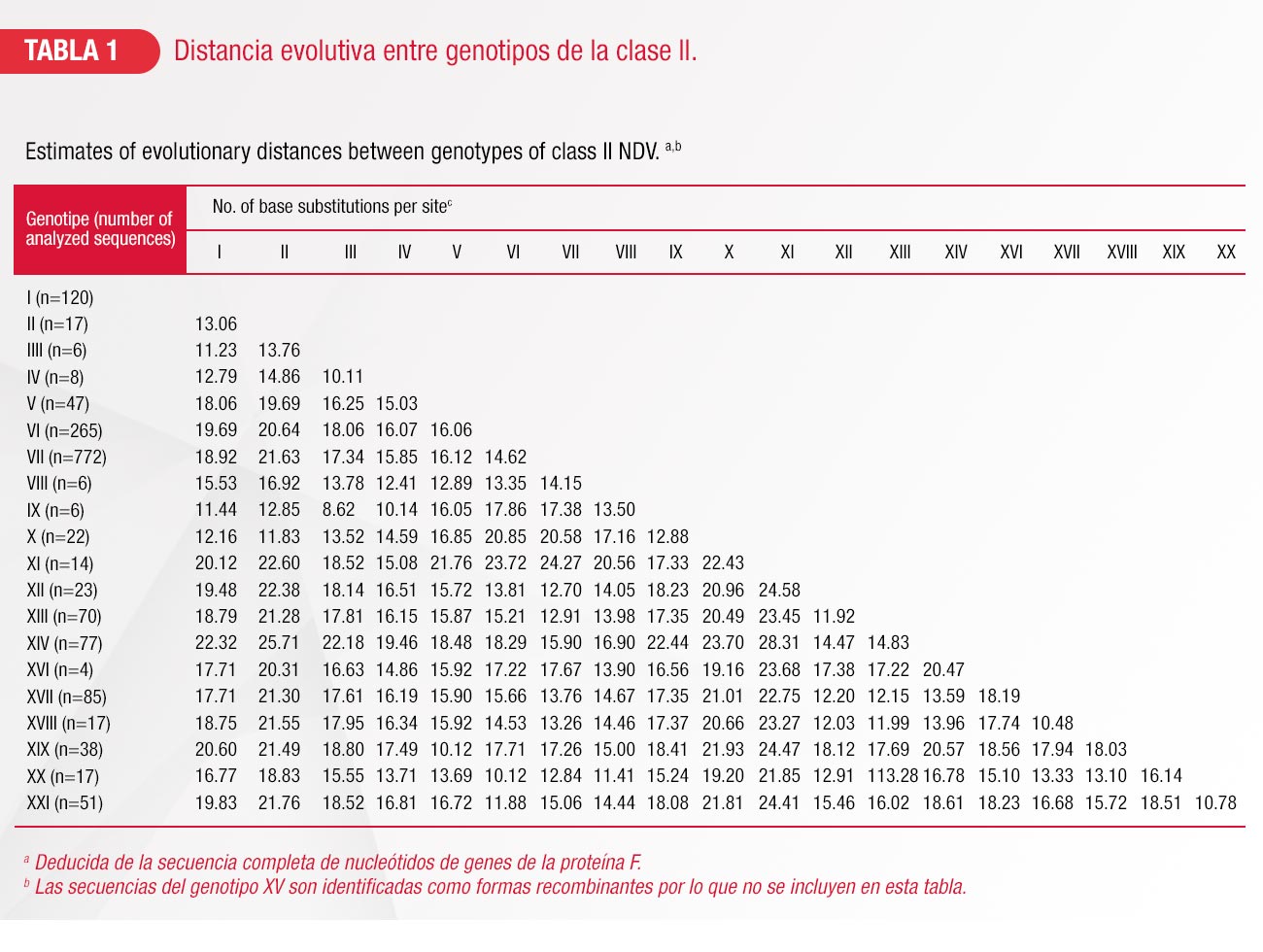
De acuerdo con clasificaciones previas, los genotipos I, V, VI, VII, XII, XIII, XIV y XVIII se confirman que están divididos en sub-genotipos (Tabla 2).9 El número de sub-genotipos existentes en los genotipos I, XIV y XVIII se mantienen igual (cuatro, dos y dos respectivamente). Para el caso de los genotipos II, III, IV, VIII, IX, XI, XVI, XIX y XX no se identifican nuevos subgenotipos9.
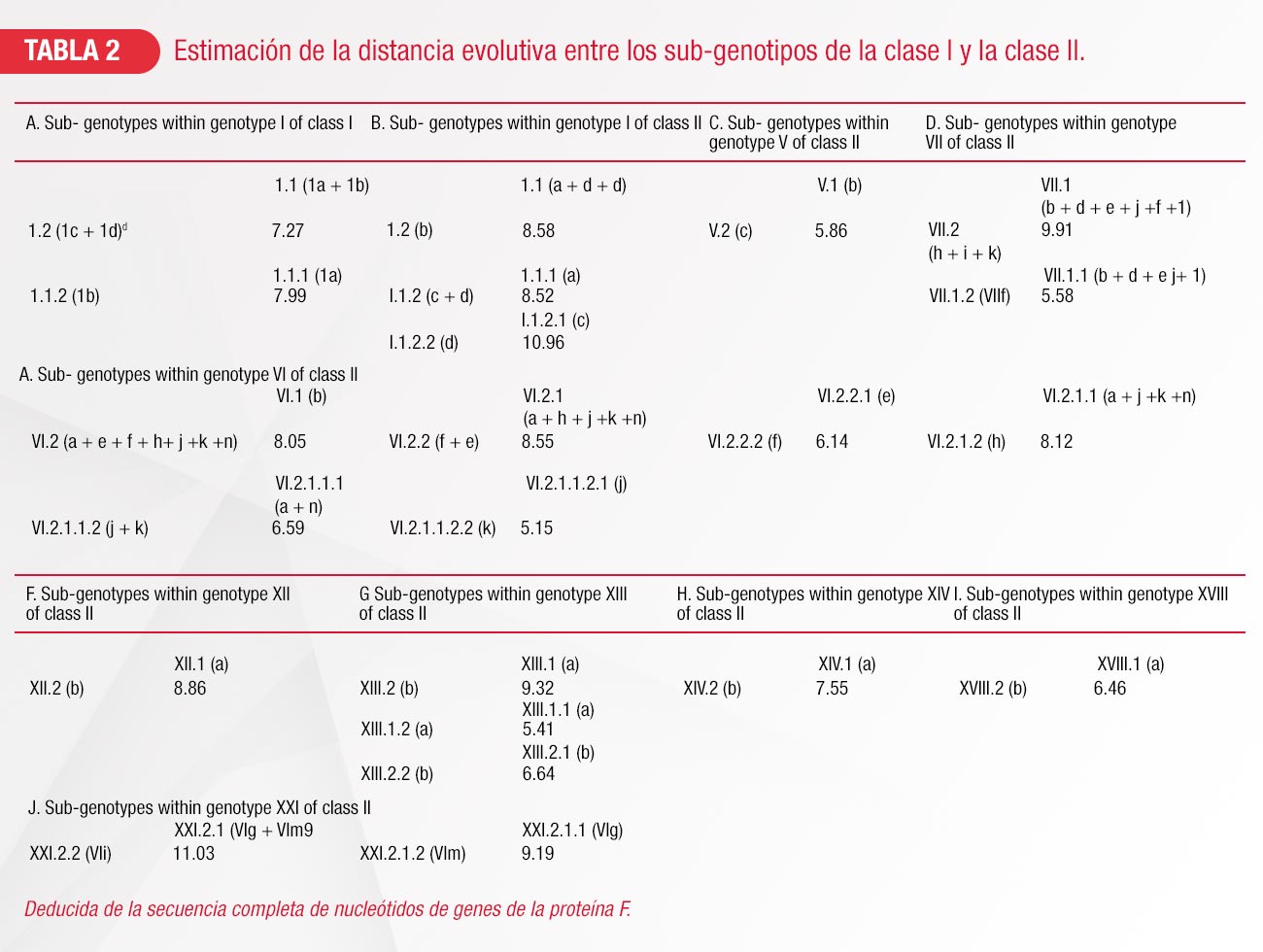
Desde los años 70´s, virus del Genotipo V han sido frecuentemente reportados en Centroamérica incluyendo países como Honduras (2000 y 2007), Nicaragua (2001) y Belice (2008), sugiriendo que este genotipo puede estar establecido en algunos reservorios desconocidos10. En Norteamérica, la frecuencia de brotes en México ha resultado en el aislamiento de cepas virulentas de la Enfermedad de Newcastle del genotipo V in 1988, 1996, 2000, 2001, 2005 y 2008 a 201111. Tanto en Centroamérica como en el norte del continente americano, las cepas del Genotipo V son las que predominan, con reportes de aislamientos en aves silvestres y aves de producción6.
La variación genética de los virus del genotipo V es absolutamente representativa, haciendo esto posible identificar tres subgenotipos Va, Vb y Vc. El análisis de la secuencia de nucleótidos de los genes de la proteína de Fusión (F) nos muestra evidencia de la diferencia genética entre los tres subgenotipos. En aislamientos virales de aves comerciales de los subgenotipos Vb y Vc se encontró una diferencia entre el 4 y el 7%, sin embargo, las diferencias entre los subgenotipos de aves comerciales (Vb y Vc) comparados con el subgenotipo de aves silvestres (Va) está entre 7 y 9%. Los virus de los genotipos Vb y Vc son velogénicos viscerotrópicos, causando amplias lesiones en órganos viscerales, los virus de aves silvestres del genotipo Va pueden ser velogénicos neurotrópicos o mesogénicos, causando lesiones mínimas. En Centroamérica (Belice), los virus están dentro de un subgenotipo Vb, separados y formando su propia clada que es distinta a las cepas Vb aisladas en México12. Otra clada Vb corresponde a cepas aisladas en la Laguna en el año 200013.
Comentarios:
- La Enfermedad de Newcastle sigue siendo una de las más importantes en la industria avícola a nivel mundial, la variedad de reservorios y especies que afecta hace que haya una gran diversidad genética, actualmente y de acuerdo a la última clasificación propuesta, se reconocen XX diferentes genotipos dentro de la Clase II.
- En Centroamérica y Norteamérica el Genotipo que sigue prevaleciendo en los aislamientos de campo es el V.
- En aves en producción, es muy común el aislamiento de cepas vacunales de los genotipos I, II y V, esto se debe a que los calendarios de vacunación en algunas zonas de México son muy robustos para la protección contra la enfermedad de Newcastle.
BIBLIOGRAFÍA:
1.- ICTV, 2019. International committee on taxonomy of viruses. In: Virus Taxonomy: 2018b Release. Available at. https//talk.ictvonline.org/taxonomy/.
2.- Alexander DJ. Highly pathogenic avian influenza/Newcastle disease. In: OIE manual of diagnostic test and vaccines for terrestrial animals. World Organisation for Animal Health, Paris, France. pp. 258-282.2004.
3.- OIE, 2018. World Animal Health Information Database (WAHIS Interface)- Version 1 Available at. http://www.oie.int/wahis2/public/wahid.php/Wahidhome/Home.
4.- Sakaguchi T., Toyoda T., Gotoh B., Inocencio N.M, Kuma K., Miyata T., Nagai Y.Newcastle disease virus evolution I. multiple linages defined by sequence variability of the hemagglutinin-neuraminidase gene. Virology 169, 260-272. 1989. https://doi.org/10.1016/0042-6822 (89) 90151-7.
5.- Wise MG., Suarez DL, Seal BS, Pdersen JC, Senne DA, King DJ, Kapczynski DR, Spackman E. Development of a real-time reverse-trnscription PCR for detection of Newcastle disease virus RNA in clinical samples. Journal of Clinical Microbiology 42, 329-338. 2004. https://doi.org/10.1128/JCM.42.1.329-338.2004.
6.- Cardenas GS, Navarro LR, Morales R, Olvera MA, Marquez MA, Merino R, Miller PJ, Afonso CL, Molecular epidemiology of Newcastle disease in Mexico and the potential spillover of virus from poultry into wild birds species. Applied and Environmental Microbiology 79, 4985-4992. 2013. https:77doi.org/10.1128/AEM.00993-13.
7.- He Y, Taylor TL, Dimitrov KM, Butt S.L, Stanton JB, Goraichuck IV, Fenton H, Poulson R, Zhang J, Brown CC, Ip HS, Isodoro-Ayza M. Afonso CL. Whole-genome sequencing of genotype VI Newcastle disease viruses from formalin-fixed paraffin-embedded tissue from wild pigeons reveals continuos evolution and previously unrecognized genetic diversity in the U.S. Virology Jounal. 15 (1):9. 2018. https://doi.org/10.1186/s12985-017-0914-2.
8.- Dimitrov KM, Celia A, Afonso CL, Albina E, Bahl J, Berg M, Briand FX, Brown IH, Choi K, Chvala I, Diel DG, Durr PA, Ferreira HL, Fusaro A, Gil P et al. Infection, Genetics and Evolution 74. 2019.
9.- Dimitrov KM, Ramey AM, Qiu X, Bahl J, Afonso CL. Temporal, geographic, and host distribution of avian paramyxovirus 1 (Newcastle disease virus) Infect. Genet. Evol. 39, 22-34. 2016. https://doi.org/10.1186/s12985-017-0741-5.
10.- Brown JA, Gongora V, Hartley D, Oura C. Areview of eight high-priority, economically important viral pathogens of poultry within the Caribbean region. Veterinary Science. 5, 14. 2018. https://doi.org/10.3390/vetsci5010014.
11.- Absalon AE, Matias MA, Garcia LJ, Morales GA, Toscano CA, Lucio DE, Cortes EDV. Complete genome analysis of velogenic Newcastle disease virus reference strain “Chimalhuacan”: evolution of viral lineages in Mexico. Virus Genes 49, 233-236. 2014.
12.- Susta L, Hamal KR, Miller PJ, Cardenas GS, Brown, CC, Pedersen JC, Gongora V, Afonso CL. Separate evolution of virulent Newcastle disease viruses from Mexico and Central America. Journal of Clinical Microbiology 52, 1382-1390. 2014. https://doi.org/10.1128/JCM.00066-14.
13.- Merino R, Villegas H, Quintana JA, Calderon N. Characterization of Newcastle disease viruses isolated from chicken, gamefowl, pigeon and quail en Mexico. Veterinary Research Communications 33, 1023-1030. 2009.
Comentarios (0)


 Español
Español  Inglés
Inglés 
