Para dejar un comentario Regístrate aquí o si ya tienes una cuenta debes Iniciar sesión

Porcinos
agosto 17, 2020
El ABC del control de la Pleuroneumonía contagiosa porcina, Parte 2
Jesús Antonio Sánchez Sosa
PRUEBAS DIAGNÓSTICAS
Existen diferentes métodos para demostrar la infección por A. pleuropneumoniae. El aislamiento bacteriano es útil para demostrar la presencia en animales con signología clínica y puede hacerse a partir de muestras de tejido pulmonar y tonsilas. Es importante considerar que las muestras deben provenir de animales sin tratamiento antibiótico previo y corresponder a casos agudos de la enfermedad, ya que el porcentaje de éxito para el aislamiento a partir de enfermos crónicos es muy bajo. Como análisis complementario se puede realizar un antibiograma para determinar los antimicrobianos de mayor efectividad.
Los estudios moleculares como la prueba de PCR, se pueden realizar como alternativa al aislamiento bacteriano si no es posible realizarlo por un tratamiento antibiótico previo y está indicado en casos de enfermedad crónica. Se realizan a partir de tejido pulmonar y tonsilas o hisopados de estos. Existen pruebas de PCR muy específicas como la descrita por Tonpitak et al (2007), que han sido de interés diagnóstico para diferenciar entre cepas de A. pleuropneumoniae y A. porcitonsillarum. Mientras que la primera es un patógeno estricto, la segunda es parte de la microbiota normal y se puede aislar de cerdos sanos, sin embargo ambas bacterias reaccionan igual a los métodos de identificación bioquímica tradicionales.
Los estudios serológicos son muy importantes en el diagnóstico y control de la enfermedad, ya que permiten conocer la cinética de la enfermedad, detectar animales asintomáticos infectados y establecer el momento óptimo de la vacunación. Existen dos tipos de pruebas serológicas. La primera basada en la toxina APX IV que detecta todas las cepas de A. pleuropneumoniae sin discriminación de serotipos y es útil para determinar infecciones de campo y duración de la inmunidad materna. El otro tipo de pruebas está basada frente a los polisacáridos capsulares de App, lo que permite identificar anticuerpos contra grupos de serotipos aportando una indicación de la virulencia (Thomson, 2010).
Actualmente con los tipos de kits serológicos comerciales, no es posible evaluar de manera eficiente la respuesta a la vacunación. El kit basado en APX IV, solo detectará anticuerpos frente a esa toxina que es generada por la infección de campo y no por la vacunación. Con los otros tipos de kit serológicos, se debe tomar en cuenta que los anticuerpos generados por una bacterina generalmente se dirigen contra ciertas estructuras de la bacteria como la cápsula, algunas proteínas y en menor medida contra LPS. A pesar de este tipo de kit este sensibilizado con un LPS purificado, estos han sido estandarizados para detectar eficientemente anticuerpos generados por la infección y no por la vacunación (Gottschalk, 2017). De igual manera la seroconversión por vacunas basadas en toxinas no puede ser evaluada ya que no hay kits comerciales que detecten anticuerpos frente a las toxinas que se incluyen en estos biológicos.
Finalmente la serotipificación de las cepas es importante como herramienta diagnóstica para elegir la vacuna más adecuada a las condiciones particulares de cada granja. Existe la serotipificación tradicional el cual está basado en una prueba de coaglutinación y permite diferenciar entre 15 serotipos de App, sin embargo en ocasiones algunos aislados pueden presentar reacciones cruzadas frente a más de un antisuero. Para evitar lo anterior se han desarrollado técnicas moleculares, algunas de ellas detectan serotipos específicos y otras grupos de serotipos. Ambas pruebas para determinar el serotipos requieren un aislamiento previo de la bacteria (Gerber et al, 2016).
ESTRATEGIAS DE CONTROL
Antibioterapia
Generalmente los cerdos enfermos presentan anorexia pero no dejan de beber agua, sin embargo en los casos agudos de App, esto podría ser diferente por el grado de afectación del sistema cardiorrespiratorio, por lo que el tratamiento inyectable individual es de suma importancia. Es necesario el tratamiento parenteral de los animales infectados y los de corrales adyacentes al ser considerados individuos expuestos aunque no presenten signos clínicos de la enfermedad, ya que si bien la principal vía de transmisión es el contacto directo entre cerdos, la transmisión por aerosoles también juega un papel importante en el contagio de la enfermedad al poder ser transmitido fácilmente a una distancia de al menos 2.5 metros (Jobert et al, 2000).
Debido a la rapidez de la evolución de A. pleuropneumoniae, en muchas ocasiones es necesario establecer tratamientos antibióticos sin conocer previamente la susceptibilidad del patógeno que puede resultar en una inadecuada respuesta a la terapia antibiótica y poco éxito en la resolución clínica de la enfermedad.
En México se han estudiado los índices de susceptibilidad antimicrobiana dependiendo del serotipo identificado en granjas con problemas agudos de la enfermedad (Sánchez et al, 2018). Antimicrobianos como la tilmicosina o la combinación de sulfamonometoxina + trimetoprim, presentaron resultados favorables a nivel in vitro contra los serotipos 1, 4, 5 y 7 de App aislados en México y que son considerados como los de mayor prevalencia en Norteamérica (Gottschalk, 2015). Por el contrario se observó que antibióticos como la amoxicilina, enrofloxacina y penicilina presentaron altos niveles de resistencia contra los mismos serotipos, por lo que su utilidad es limitada en infecciones agudas de App.
En otros estudios reportados por Gutiérrez et al (2006), se ha determinado que existe un aumento significativo de resistencia a las tetraciclinas y gentamicina de cepas de A. pleuropneumoniae recolectados durante 1997-2004 en España en comparación con aislamientos obtenidos durante 1987-1988, fenómeno que puede estar asociado al uso continuo de estos agentes antimicrobianos en dosis sub terapéuticas. Sin embargo otros antimicrobianos como la cefalotina y florfenicol presentaron resultados favorables in vitro para el tratamiento de App.
Las medicaciones preventivas son útiles cuando se conoce la cinética de la enfermedad. Con el uso de la serología se puede determinar el momento en el cual ocurre la infección de los animales y establecer esquemas de medicación oportunas.
Vacunación
Uno de los elementos fundamentales en el control de la enfermedad es la inmunidad conferida por las vacunas. Existen en la actualidad diversos tipos de vacunas comerciales con diferentes características entre las cuales se pueden destacar las bacterinas, las cuales son serotipo específicas, por lo tanto necesariamente se debe conocer el serotipo o los serotipos presentes en la granja, porque es posible que haya más de uno asociado en los problemas clínicos observados. Los anticuerpos generados por la bacterina se dirigen contra antígenos presentes en el cuerpo de la bacteria: cápsula, proteínas de superficie, pared bacteriana, etc., y estos se adhieren a la bacteria mediante un proceso de opsonización para finalmente destruirla, por lo tanto este tipo de inmunógenos ayudan a reducir la carga bacteriana (Gottschalk, 2016).
Otro tipo son los biológicos a base de toxinas purificadas, cuya generación de anticuerpos reaccionará específicamente contra las toxinas generadas mediante un proceso de neutralización, evitando el daño tisular ocasionado por éstas, sin embargo al no actuar frente a la bacteria como tal, puede seguir habiendo reproducción bacteriana en el tejido pulmonar y por lo tanto este tipo de inmunógenos no reducen la carga bacteriana (Gottschalk, 2016).
Finalmente existen las vacunas combinadas a base de bacterinas y toxoides con la ventaja de generar inmunidad frente a los serotipos y las toxinas incluidas en el biológico, reduciendo así la carga bacteriana y evitando el daño tisular que ocasionan las toxinas bacterianas. (Gottschalk, 2016).
Existen algunos prototipos de vacunas basadas en polisacáridos y lipopolisacáridos (LPS) que podrían proveer una protección completa contra los 18 serotipos reconocidos (Loera et al, 2018). Otro tipo de vacuna prototipo ha sido evaluada por Wang et al (2009) a base de toxinas recombinantes ApxIA, ApxIIA, ApxIIIA, ApxIVN y la 42-kD OMP (proteína de membrana externa). Los resultados mostraron que ApxIV contribuye a la producción de un alto nivel de anticuerpos dirigidos contra los antígenos de vacunación y confiere una fuerte protección contra los desafíos de diferentes serotipos A. pleuropneumoniae, por lo que la inclusión de la toxina APX IV en un futuro puede representar el desarrollo de vacunas comerciales más eficientes. También se han probado bajos condiciones experimentales el uso de algunas vacunas vivas atenuadas y se considera que podrían llegar a tener mayor potencial para proteger contra los desafíos de serotipos homólogos y heterólogos (Maas et al, 2006).
Independientemente del tipo de vacuna seleccionada, existen esquemas diferentes con objetivos particulares, los cuales se describen a continuación:
Vacunación masiva del hato reproductor
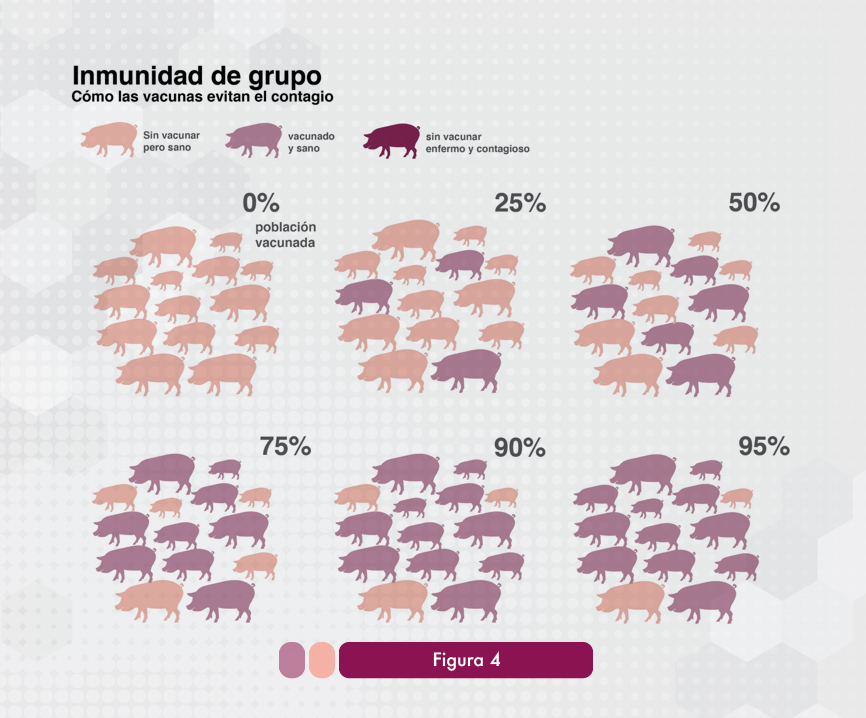
Este esquema está indicado para buscar generar una adecuada inmunidad de hato (rebaño). El término de inmunidad colectiva tuvo su origen en salud humana en la década de los 30’s al describir un fenómeno observado en un brote de sarampión en niños. Después de que un número significativo de estos se hubiera infectado y generado inmunidad, el número de casos nuevos disminuyó incluso en niños susceptibles.
La inmunidad de hato se usa para describir la proporción de animales inmunes que debería provocar una disminución en la incidencia de infecciones nuevas. A medida que crece la proporción de animales con inmunidad adquirida por infección natural o vacunación, el riesgo de infección para animales susceptibles se reduce debido a la presencia, cercanía y número de individuos inmunes presentes en la población (Figura 4).
Vacunación preparto en hato reproductor
El objetivo de la vacunación en cerdas próximas a parto es conseguir una adecuada transferencia de inmunidad pasiva al elevar las concentraciones de anticuerpos específicos en el calostro. Sabiendo que el contagio vertical de la madre al lechón es un factor importante en la transmisión de la enfermedad, el proveer de anticuerpos específicos durante las primera horas de vida del lechón es esencial para reducir y retrasar la colonización bacteriana.
Vacunación en cerdos de la línea de producción
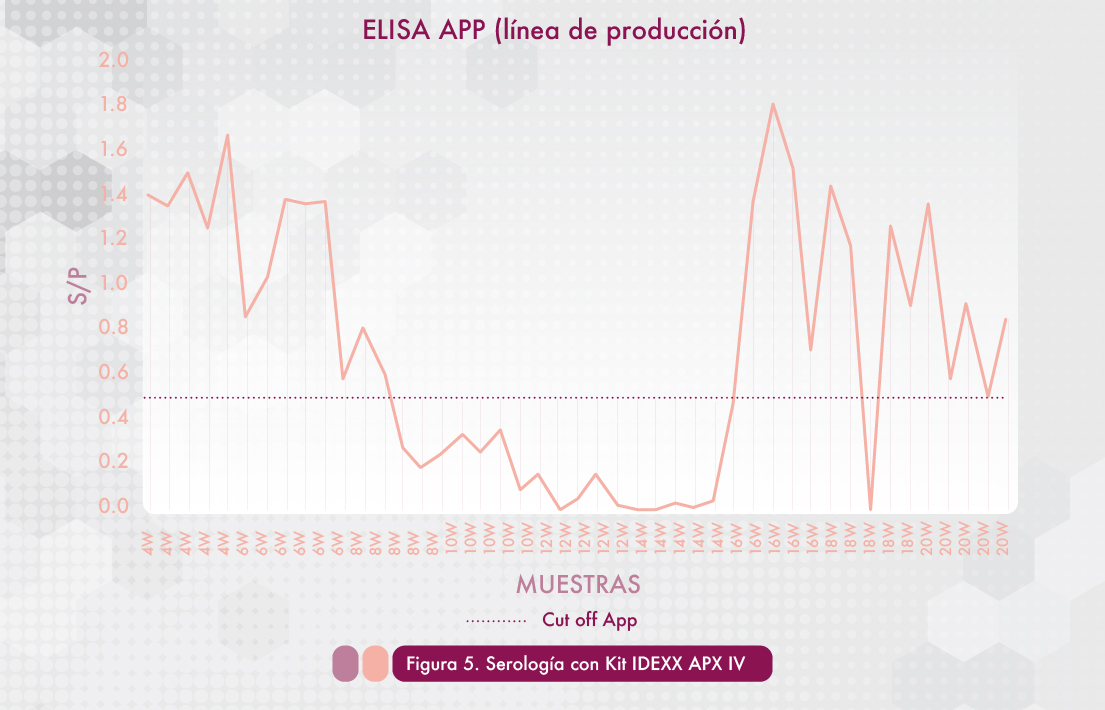
Existiendo una adecuada transferencia de inmunidad pasiva mediante el calostro, la duración de ésta podría oscilar entre 8 y 10 semanas. Conocer la duración de la inmunidad pasiva es importante ya que puede existir un fenómeno de interferencia entre los anticuerpos presentes en el animal y el antígeno vacunal (Vigre et al, 2003).
En la Figura 5, se pueden observar dos hallazgos importantes, el primero es la duración de la inmunidad transmitida por la madre al lechón, la cual tiene una duración de menos de 8 semanas, por lo tanto los calendarios de vacunación en el lechón no deberían comenzar antes de esta edad para evitar la interferencia. Como segundo punto importante se observa que alrededor de las 16 semanas de edad, existe una infección de campo, lo que da la pauta para establecer el momento idóneo para la vacunación.
Vacunación de hembras de reemplazo
El objetivo del desarrollo de las hembras jóvenes, ya sea dentro de una unidad de desarrollo de reemplazos (GDU) o dentro de la misma granja, no solo es garantizar que las primerizas tengan la edad y el peso adecuados y que hayan presentado un ciclo estral correcto, sino que también proporciona un lugar para la aclimatación (exposición y recuperación a los patógenos del hato reproductor).
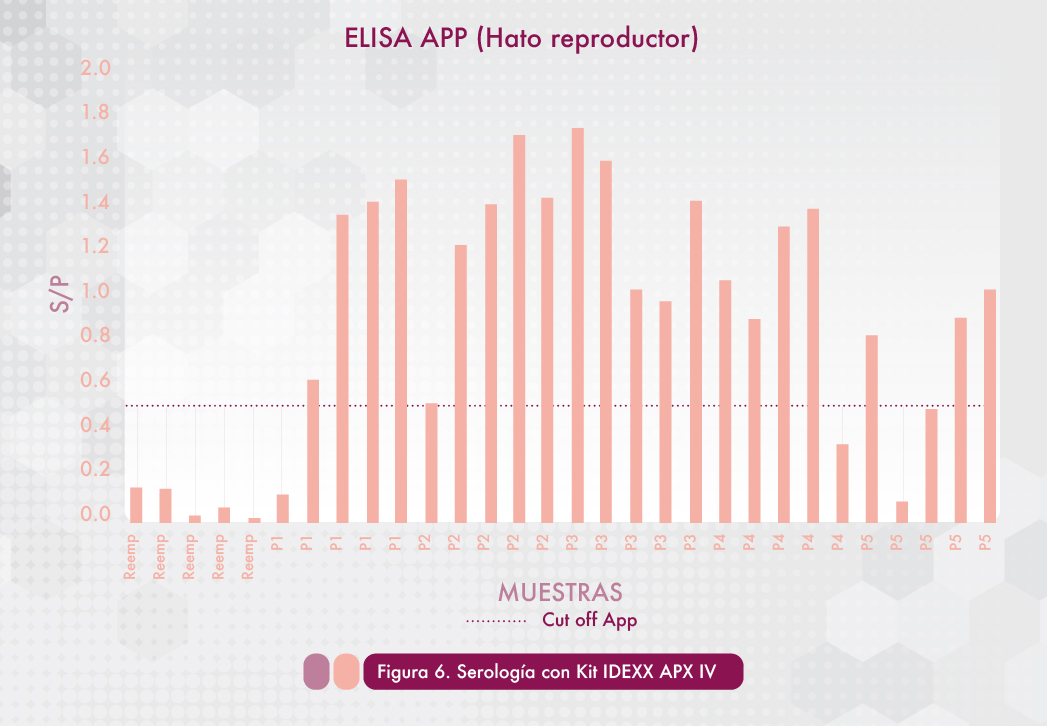
Las hembras de reemplazo que ingresan al hato, siempre serán un desafío importante para mantener la estabilidad del mismo, por lo tanto el objetivo de vacunar en la etapa de aclimatación es generar cierto nivel de inmunidad antes de la entrada al hato infectado y evitar introducir animales susceptibles de desarrollar la enfermedad. En la Figura 6 se observa un seroperfil del hato reproductor en donde se aprecia que las hembras de reemplazo son seronegativas, sin embargo las hembras de mayor paridad presentan anticuerpos contra App.
Las vacunas pueden proporcionar altos niveles de protección contra la enfermedad, reducir la mortalidad y los costos por tratamiento antibiótico y sintomático, favorecen la ganancia de peso diaria y conversión alimenticia, además de menor cantidad de decomisos en rastro por neumonía, pleuritis y pericarditis (Del Pozo Sacristán, 2014)
El control y la prevención de la enfermedad es un proceso en el que influyen diversos factores. Desde la inspección de la granja para evaluar las condiciones sanitarias y corregir factores predisponentes que faciliten la presentación de la enfermedad, hasta el uso de las pruebas diagnósticas que nos permita conocer información importante sobre la dinámica de infección de la enfermad. Con el conocimiento de esta información es posible establecer programas de control adecuadas para cada unidad de producción en particular.
REFERENCIAS BIBILIOGRÁFICAS
Arnal JL, Benito AA, Fernandez A, Martín D (2020). Actinobacillus pleuropneumoniae: diversidad epidemiológica en España. Revista Suis 166, pp. 18-22
Bossé J.T., Li Y., Sarkozi R., Fodor L., Lacouture S., Gottschalk M., Casas Amoribieta M (2018). Proposal of serovars 17 and 18 of Actinobacillus pleuropneumoniae based on serological and genotypic analysis, Veterinary Microbiology, 217 , pp. 1-6.
Del Pozo Sacristán R, Michiels A, Martens M, Haesebrouck F, Maes D. Efficacy of vaccination against Actinobacillus pleuropneumoniae in two Belgian farrow-to-finish pig herds with a history of chronic pleurisy. Vet Rec. 2014;174(12):302
Dreyfus A, A Schaller, S Nivollet, R Segers, M Kobisch, L Mieli, V Soerensen, D Hüssy, R Miserez, W Zimmermann, F Inderbitzin, J Frey (2004). Use of recombinant ApxIV in serodiagnosis of Actinobacillus pleuropneumoniae infections, development and prevalidation of the ApxIV ELISA. Vet Microbiol 99, 227-238
Gerber PF, Opriessnig T (2016). Enfermedad causada por "Actinobacillus pleuropneumoniae y su diagnóstico. Revista Albéitar ISSN 1699-7883, Nº. 192, 2016, págs. 4-7
Gottschalk M. (2012) Actinobacillosis. In: Zimmerman JJ, Karricker L, Ramirez A, Schwartz KJ, Stevenson GW, editors. Diseases of Swine. 10 ed. Ames, IA: John Wiley & Sons, Inc. pp. 653-669.
Gottschalk M. Prevención de la enfermedad causada por Actinobacillus pleuropneumoniae (App). Anaporc. Vol. 14, Nº. 140, 2017, págs. 26-29.
Gottschalk, M (2015). Patogenicidad de Actinobacillus pleuropneumoniae. SUIS Nº 121 Octubre
Gottschalk, M (2016). Cómo diagnosticar y controlar App. Porciforum, Lérida España.
Gutiérrez-Martín CB, del Blanco NG, Blanco M, Navas J, Rodríguez-Ferri EF. Changes in antimicrobial susceptibility of Actinobacillus pleuropneumoniae isolated from pigs in Spain during the last decade. Vet Microbiol. 2006;115(1-3):218-222.
Jobert JL, Savoye C, Cariolet R, Kobisch M, Madec F (2000). Experimental aerosol transmission of Actinobacillus pleuropneumoniae to pigs. Can J Vet Res. 64(1):21-26.
Loera-Muro A, Angulo C. New trends in innovative vaccine development against Actinobacillus pleuropneumoniae. Vet Microbiol. 2018;217:66-75.
Maas, A., Jacobsen, I. D., Meens, J., & Gerlach, G.-F. (2006). Use of an Actinobacillus pleuropneumoniae multiple mutant as a vaccine that allows differentiation of vaccinated and infected animals. Infection and Immunity, 74, 4124–4132.
Park J, Seo KW, Kim SH, et al. Nasal immunization with M cell-targeting ligand-conjugated ApxIIA toxin fragment induces protective immunity against Actinobacillus pleuropneumoniae infection in a murine model. Veterinary Microbiology. 2015 May;177(1-2):142-153.
Pomorska-Mól M, Dors A, Kwit K, Kowalczyk A, Stasiak E, Pejsak Z. Kinetics of single and dual infection of pigs with swine influenza virus and Actinobacillus pleuropneumoniae. Vet Microbiol. 2017;201:113-120.
Qi W, Zhu R, Bao C, et al. Porcine circovirus type 2 promotes Actinobacillus pleuropneumoniae survival during coinfection of porcine alveolar macrophages by inhibiting ROS production. Vet Microbiol. 2019;233:93-101.
Rodríguez Ferri, E.F.; Barceló, J.; Gómez, S.: Sánchez Vizcaino, J.M. Actinobacillus pleuropneumoniae. http://www.sanidadanimal.info/cursos/curso/6/inf.htm
Sánchez JA, Carrera VM, Munguia J (2018). Susceptibilidad antimicrobiana de diferentes serotipos de Actinobacillus pleuropneumoniae aislados en México. Congreso AMVEC 2018.
Stockhofe NZ, Wisselink H, Post J, Weesendorp E (2013). PRRSV type 1 induces aggravation of infection with a mild virulent Actinobacillus pleuropneumoniae serotype 2 strain. International PRRS Symposium
Taylor DJ. In: Diseases of Swine. 8. Straw BE, Zimmerman JJ, Allaire SD, Taylor DJ, editor. Merial Edition; 2000. Actinobacillus pleuropneumoniae.
Thacker EL, Halbur PG, Ross RF, Thanawongnuwech R, Thacker BJ (1999) Mycoplasma hyopneumoniae potentiation of porcine reproductive and respiratory syndrome virus-induced pneumonia. J Clin Microbiol 37: 620–627.
Thacker EL, Thacker BJ, Janke BH (2001) Interaction between Mycoplasma hyopneumoniae and swine influenza virus. J Clin Microbiol 39: 2525–2530.
Thanawongnuwech R, Brown GB, Halbur PG, Roth JA, Royer RL, et al. (2000) Pathogenesis of porcine reproductive and respiratory syndrome virus-induced increase in susceptibility to Streptococcus suis infection. Vet Pathol 37: 143–152.
Thomson J. Diagnostic tests for pleuropneumonia (Actinobacillus pleuropneumoniae). 2010
Tobias TJ, Klinkenberg D, Bouma A, et al. A cohort study on Actinobacillus pleuropneumoniae colonisation in suckling piglets. Prev Vet Med. 2014;114(3-4):223-230.
Tonpitak W, Rohde J, Gerlach GF. Prevalence of "Actinobacillus porcitonsillarum" in porcine tonsils and development of a diagnosis duplex PCR differentiating between "Actinobacillus porcitonsillarum" and Actinobacillus pleuropneumoniae. Vet Microbiol. 2007;122(1-2):157-165.
Vargas M (2015). Aislamiento de Actinobacillus pleuropneumoniae de tonsilas en lechones de 1 a 4 semanas de edad en condiciones de granja comercial. Departamento de Ciencias Biológicas, Facultad de Estudios Superiores Cuautitlán, UNAM.
Vigre, Håkan & Ersbøll, Annette & Sørensen, V. (2003). Decay of Acquired Colostral Antibodies to Actinobacillus pleuropneumoniae in Pigs. Journal of veterinary medicine. B, Infectious diseases and veterinary public health. 50. 430-5. 10.1046
Wang C, Wang Y, Shao M, et al. Positive role for rApxIVN in the immune protection of pigs against infection by Actinobacillus pleuropneumoniae. Vaccine. 2009;27(42):5816-5821.
Yu J, Wu J, Zhang Y, Guo L, Cong X, et al. (2012) Concurrent highly pathogenic porcine reproductive and respiratory syndrome virus infection accelerates Haemophilus parasuis infection in conventional pigs. Vet Microbiol 158: 316–321.
Comentarios (0)


 Español
Español  Inglés
Inglés