Para dejar un comentario Regístrate aquí o si ya tienes una cuenta debes Iniciar sesión

Porcinos
mayo 3, 2021
Efectos clínicos de las Micotoxinas en cerdos; un escenario complejo en la susceptibilidad de enfermedades.
Víctor Manuel Carrera Aguirre
Las reacciones biológicas tras la ingestión de micotoxinas varían desde enfermedades agudas y manifiestas con una elevada morbilidad y mortalidad hasta trastornos crónicos e insidiosos con una reducción de la productividad animal. En dosis elevadas, la exposición a las micotoxinas provoca una citotoxicidad general, a menudo relacionada con la inhibición de la síntesis de macromoléculas.
Cada micotoxina se asocia con un “órgano diana”, u “órgano susceptible”. Se llama así al órgano más afectado por una micotoxina en particular, causando lesiones características.
Se reconocen dos tipos de hongos, los de campo y los de almacenamiento. Los hongos de campo son producidos en vida de la planta antes de la cosecha como el Fusarium spp. y el Claviceps spp. pueden producir toxinas que provocan una alteración del rendimiento reproductivo. Los hongos de almacenamiento se producen después de la cosecha, durante el almacenamiento del grano como el Aspergillus y Penicillium. Los signos relacionados con la micotoxicosis pueden aparecer con concentraciones inferiores al límite de detección. Las micotoxinas pueden seguir estando presentes en los granos a pesar de los resultados analíticos negativos e incluso los signos clínicos pueden ser muy pronunciados, pero en muchos casos las manifestaciones clínicas son imperceptibles y no están presentes en el hato de forma regular [Kanora A. and Maes D. 2009].
Las micotoxinas del género Fusarium más importantes desde el punto de vista toxicológico son los tricotecenos tipo A y B incluidos el deoxinivalenol (DON) y la toxina T-2, la zearalenona (ZEN) y la fumonisina B1 (FB1). Mientras que las micotoxinas producidas por hongos del género Aspergillus y Penicillium son la Aflatoxina B1 (AFB1) y Ocratoxina A (OTA).
GENERALIDADES
Aunque las micotoxinas son ahora objeto de un mayor debate y consideración, muchos productores siguen sin estar informados del alcance de la amenaza que las micotoxinas pueden suponer para sus animales, así como de la relación costo/beneficio relacionada con los programas de gestión preventiva.
La presencia de micotoxinas en el alimento de los cerdos tiene una naturaleza dinámica y es difícil predecir los efectos exactos sobre el rendimiento productivo.
La micotoxicosis puede afectar a los cerdos durante todas las fases de producción. La exposición a estas micotoxinas puede producirse como una gran dosis única (aguda) o en cantidades más pequeñas a lo largo del tiempo (crónica), y sus efectos pueden ser amplios:
- Inducen lesiones bioquímicas primarias e impactan en las funciones/eventos celulares tempranos en la cascada de eventos que conducen a la lesión celular tóxica o a la desregulación celular [Bryden, 2012].
- En dosis bajas, las micotoxinas afectan a las funciones de diversos tejidos y órganos, como el tracto gastrointestinal, los tejidos hepáticos o renales, así como el sistema nervioso, reproductivo, inmunitario y cambios en el comportamiento alimentario.
- Algunas micotoxinas también tienen efectos genotóxicos, carcinogénicos y teratogénicos [Maresca and Fantini, 2010]
- Las micotoxinas que suprimen las funciones inmunitarias pueden provocar una disminución de la resistencia a las enfermedades, la reaparición de infecciones crónicas o una escasa eficacia de los programas de vacunación, incluso a niveles crónicos bajos [Gadd J. 2015]
Los efectos de la micotoxicosis pueden depender del tipo o la concentración de la micotoxina, la duración de la exposición, edad, nutrición y estado de salud del animal. Para complicar aún más las cosas, múltiples micotoxinas pueden tener efectos negativos mayores con funciones sinérgicas en el rendimiento y la salud de los cerdos [Grenier and Oswald, 2011].
ROL DE LAS MICOTOXINAS EN LA SUSCEPTIBILIDAD A ENFERMEDADES INFECCIOSAS
Una de sus más graves consecuencias es la inmunosupresión de los animales afectados, y esta depresión de la respuesta inmune, a su vez, produce un aumento de la incidencia de patologías, lo que redunda en pérdidas económicas: menor producción, aumento del consumo de antibióticos, etc.
La inmunomodulación inducida por las micotoxinas puede afectar a la inmunidad innata y adaptativa mediante un deterioro de la función de los macrófagos y los neutrófilos, una disminución de la actividad de los linfocitos T y B y la producción de anticuerpos. Además del efecto de las micotoxinas de Fusarium en el huésped animal o humano, estas micotoxinas pueden alterar el metabolismo del patógeno, lo que puede modificar el resultado de la enfermedad infecciosa [Osselaere, A 2012]
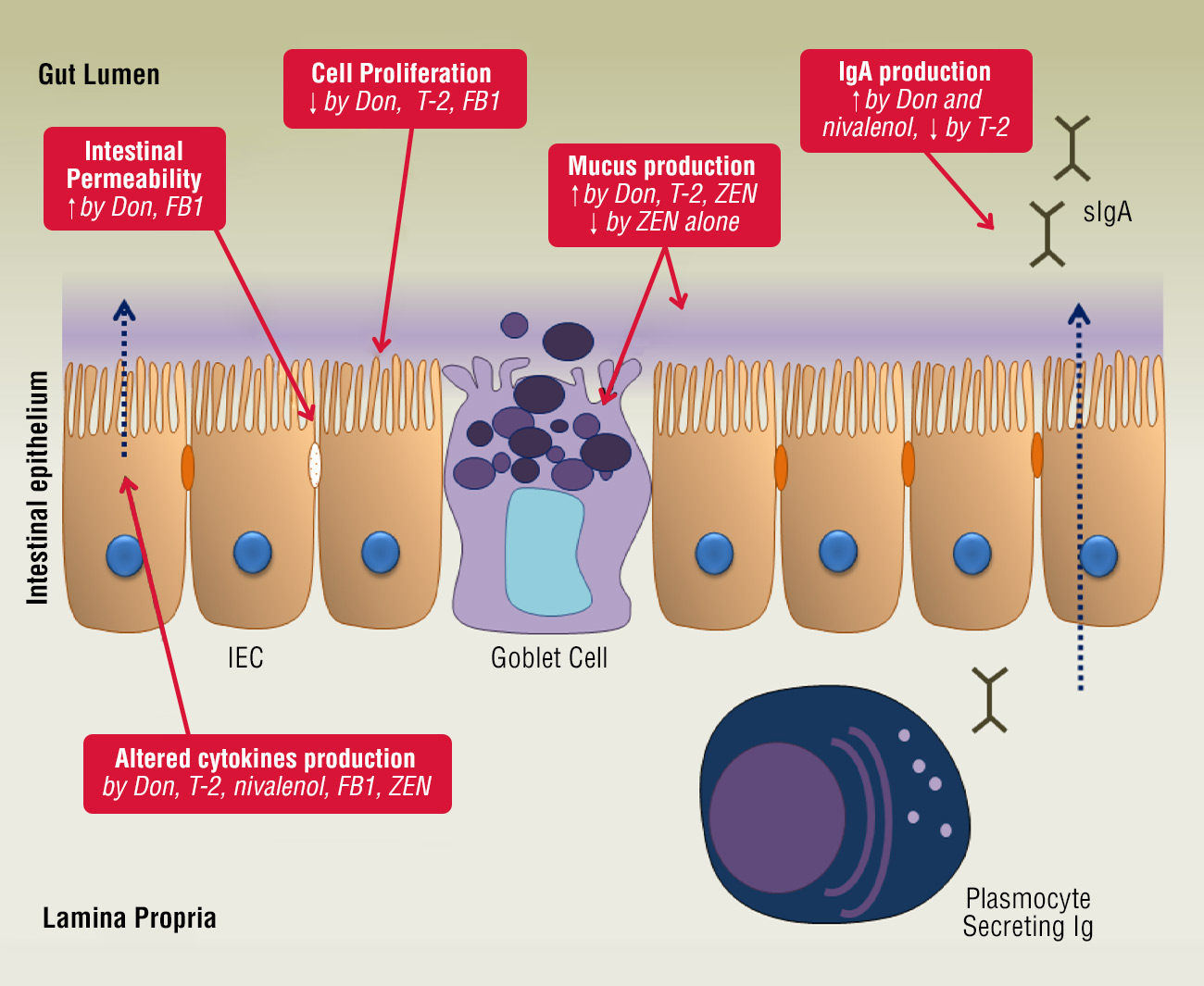
Imagen 1: El efecto de las micotoxinas de Fusarium en el epitelio intestinal
Una variedad de micotoxinas de Fusarium alteran los diferentes mecanismos de defensa intestinal, incluyendo la integridad epitelial, la proliferación celular, la capa de moco, las inmunoglobulinas y la producción de citoquinas. [Gunther et., al. 2011]
Tras la ingesta oral de cantidades bajas o moderadas de estas micotoxinas, la capa de células epiteliales gastrointestinales será la primera en quedar expuesta [Bouhet, S. and Oswald, I.P. 2005]. La mucosa intestinal actúa como barrera, impidiendo la entrada de antígenos extraños, incluyendo proteínas alimentarias, xenobióticos (como fármacos y toxinas), microbiota comensal y patógenos en los tejidos subyacentes [Oswald, I.P 2006]. La inmunidad de las mucosas, que consta de un sistema inmunitario innato y otro adaptativo, puede verse afectada por las micotoxinas del genero Fusarium. Un componente importante del sistema inmunitario innato son las células epiteliales intestinales, que están interconectadas por uniones estrechas y cubiertas de moco, producido por las células caliciformes [Schenk, M. and Mueller, C. 2008]. DON y FB1 son capaces de aumentar la permeabilidad de la capa epitelial intestinal de origen humano, porcino y aviar [Pinton, P et., al. 2009].
EFECTO DE LAS MICOTOXINAS EN LA PRESENTACIÓN DE ENFERMEDADES.
Alimentar a los cerdos con una dieta contaminada con micotoxinas provenientes de hongos del género Fusarium influye en la fase intestinal de la patogénesis de las infecciones por Salmonella Typhimurium. Las concentraciones citotóxicas de DON y T-2 potencializan la invasión intestinal y aumentan el paso de Salmonella Typhimurium a través del epitelio [Gunther et., al. 2011]. La coexposición del intestino a DON y Salmonella typhimurium resultó en un aumento de la expresión de varias citoquinas responsables de la estimulación de la respuesta inflamatoria (TNF-α) y la estimulación de los linfocitos T (IL-12). La inflamación intestinal podría ser debido a una estimulación inducida por DON y por lo tanto la translocación a través del epitelio intestinal de Salmonella Typhimurium [Vandenbroucke et., al 2011]
El consumo de alimentos contaminados con aflatoxinas aumenta la gravedad de la infección por Erysipelothrix rhusiopathiae [Cysewski et al., 1978]. Esta micotoxina interfiere en el desarrollo de la inmunidad adquirida en los cerdos tras la vacunación contra E. rhusiopathiae Del mismo modo, durante una infección experimental con Brachyspira hydysenteriae, el consumo de aflatoxinas redujo el tiempo de incubación y aumentó la gravedad de la diarrea [Joens et al.,1981].
Uno de los factores de riesgo del consumo de micotoxinas en el alimento es la aparición o el agravamiento de enfermedades víricas. Normalmente la relación es consecuencia de la inmunosupresión producida por la micotoxinas, que hace que el cerdo sea más susceptible a contraer la enfermedad. Un ejemplo de este factor de riesgo es la relación entre consumo de FB1 o DON y PRRSV o PCV2. En presencia del PCV2, DON aumenta la gravedad de la infección viral, y en presencia del PRRSV también aumenta la infección con más lesiones tisulares inducidas [Savardetal et., al.2015]. La relación de consumo de FB1 e inoculación con PRRSV describen su efecto aditivo, donde la lesión pulmonar más severa se produjo con un consumo inicial de FB1 seguido de la inoculación con PRRSV, que puede explicarse porque la inmunosupresión producida por FB1 favorece el desarrollo de PRRS. La elevación de la IgA circulante en presencia de una baja cantidad de DON puede, por el contrario, aumentar la resistencia a ciertos patógenos. De hecho, la IgA inicia una regulación rápida y transitoria de muchos genes relacionados con la inmunidad. El punto de inicio para la toxicidad de DON y las pérdidas económicas tiende a ser de 0.6 a 1.0 ppm (600 a 1000 ppb). [Pestka et al., 2004]. Se ha reportado que DON puede causar inmunosupresión e interferir con la reproducción causando abortos, ciclos irregulares, quistes ováricos, alteración de la maduración de ovocitos anestro y muerte embrionaria temprana, por lo tanto, tiende a potencializar el efecto sinergico producido por zearalenona y los problemas de toxicidad se ven agravados y aumentados.
La zearalenona es la principal micotoxina de interes en la industria porcina, provocando efectos estrogénicos, siendo las cerdas reproductoras la poblacion más susceptible a sus efectos. Se puede observar vulvovaginitis, prolapsos vaginales y rectales, atrofia ovárica así como afectación de parámetros reproductivos de interés: anestros, abortos, aumento de días no productivos
La ingestión de FB1 puede inducir infecciones intestinales, con algunas funciones del tracto digestivo afectadas. También se asoció con una mayor susceptibilidad a la infección pulmonar y un aumento de la gravedad de los cambios patológicos con patógenos bacterianos o virales Se ha demostrado que afecta las células epiteliales del intestino ocasionando un aumento en la colonización por E. coli septicémica, causando graves problemas gastrointestinales, con una mayor translocación bacteriana a los ganglios linfáticos mesentéricos y los pulmones, y en menor medida al hígado y el bazo. La ingesta crónica de dietas con ≥ 10 ppm FB1 (10,000ppb) en cerdos en crecimiento puede resultar en alteraciones significativas en los perfiles de proteínas séricas resultantes de enfermedades hepáticas y / o gastrointestinales crónicas. [Posaetal et., al 2011, Bureletal et., al ,2013] Además, FB1 disminuye la respuesta de anticuerpos específicos durante la vacunación contra Mycoplasma en cerdos.
En la ingestión de alimentos contaminados con OTA, la salmonelosis surgió espontáneamente en todos los lechones que recibieron una dieta contaminada con OTA, y cuando los animales fueron vacunados contra la salmonelosis, el consumo de alimento contaminado provocó infecciones espontáneas por Brachyspira hyodysenteriae y Campylobacter coli. Durante una infección por PCV2, la OTA aumenta la viremia y la concentración de partículas virales en tejidos (Gan et, al., 2015, Stoevetal et., al. 2000).
Asimismo, se demostró que alimentar a los cerdos con una dieta contaminada con DON inhibe la eficacia de la vacunación con la vacuna viva modificada contra el PRRSV al afectar gravemente a la replicación viral [Savard et., al.,2015]. En verracos que recibieron 0.08 ppb de OTA durante 6 semanas se observó afectación en la calidad espermática con una reducción en la viabilidad y motilidad. Adicionalmente, en cerdas afecta negativamente la maduración de los ovocitos con niveles superiores a 5 ppb.
Resultados con Toxina T-2 de estudios realizados, indican que esta especie animal estaría entre los más sensibles a los efectos de esta toxina. Los efectos observados están relacionados con efectos inmunológicos y hematológicos, con dosis desde 29 ppb por día. La Intoxicación por T-2 inhibe la síntesis proteica afectando al sistema inmunitario. Los signos clínicos son: rechazo de alimento, vómito, anorexia y pérdida de la condición corporal también, podemos observar irritaciones o erosiones en la mucosa gástrica y entérica además de dermatitis, costras y ulceraciones cutáneas en la cola y orejas de los cerdos. Toxina T-2 podría ser capaz de alterar el crecimiento de la capa de células de la granulosa afectando también la esteroidogénesis [Caloni F et., al. 2009]
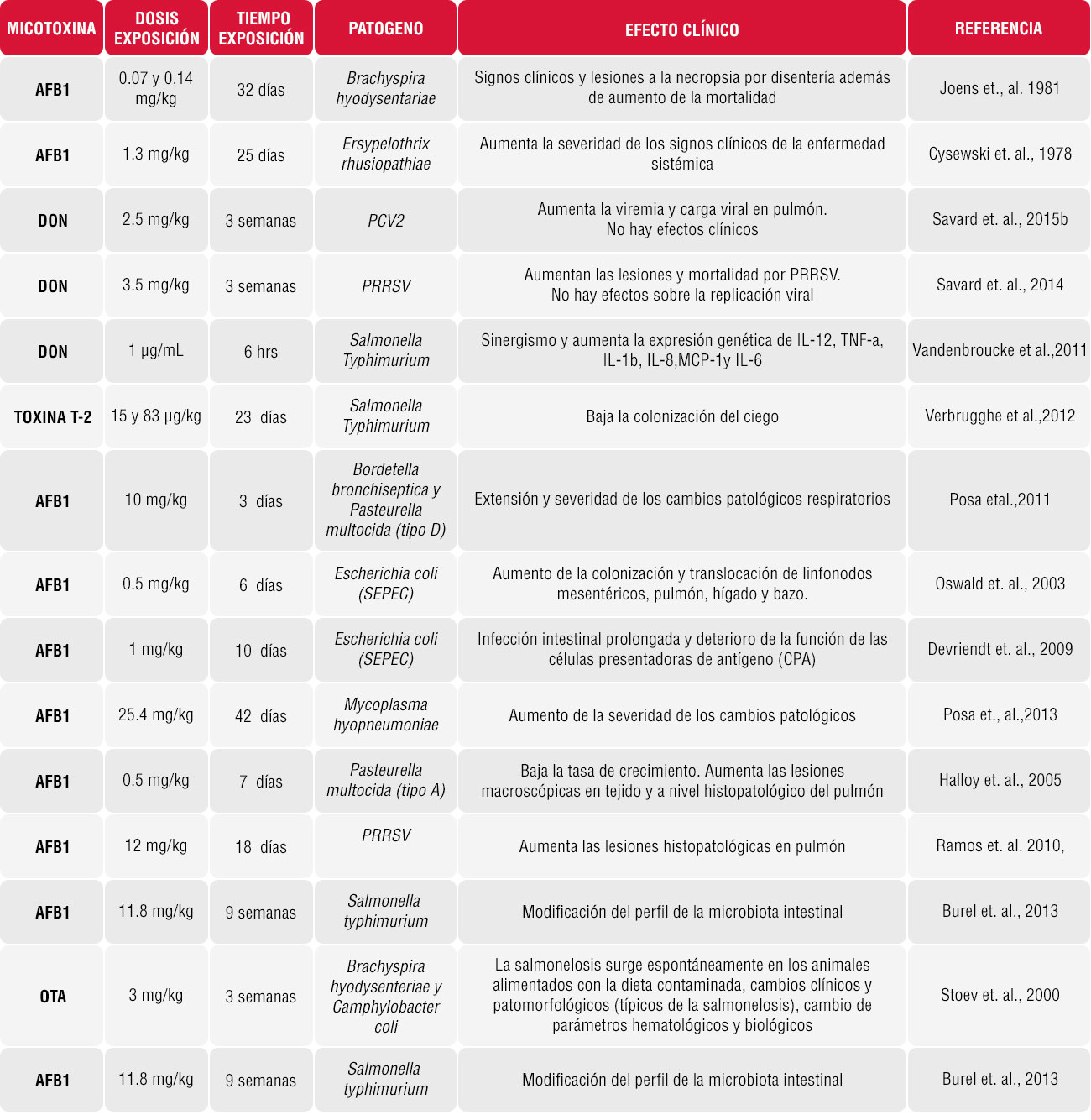
El amplio efecto inmunosupresor de las micotoxinas puede disminuir la resistencia del huésped a las enfermedades infecciosas [Antonissen et al., 2014]. Ver tabla 1.
Tabla 1: Influencia de las micotoxinas sobre la susceptibilidad a enfermedades infecciosas en cerdos [Fuente: A. Pierron et al. 2016]
CONCLUSIONES
- Puntualicemos que los efectos relacionados con las micotoxicosis pueden aparecer con concentraciones inferiores al límite de detección. El conocimiento de los efectos de las micotoxinas se está ampliando rápidamente, sobre todo gracias al desarrollo de nuevas técnicas analíticas. Dado el dinamismo de las micotoxinas y sus efectos adversos, resulta en un escenario complejo la estimación de la incidencia real de las micotoxinas sobre la salud porcina.
- Recordemos que el efecto más importante de la micotoxicosis crónica es la inmunosupresión y esta actúa como factor de riesgo a la aparición de otras enfermedades virales y bacterianas.
- Finalmente, de manera sistemática se debe implementar el diagnóstico de micotoxicosis incluyendo un estudio histopatológico del órgano dañado, combinado con el análisis del alimento para la confirmación y empatarlo de forma integral con el aspecto clínico productivo de la granja.
REFERENCIAS BIBLIOGRÁFICAS
1) Kanora A, Maes D. The role of mycotoxins in pig reproduction: a review. Veterinarni Medicina, 54, 2009 (12): 565–576
2) Maresca M,FantiniJ.Somefood-associated mycotoxins as potential risk factors in humans predisposed to chronic intestinal inflammatory diseases. Toxicon 2010;56:282e94.
3) Bryden WL. Mycotoxin contamination of the feed supply chain: implications for animal productivity and feed security. Animal Feed Sci Technol 2012;173: 134e58.
4) Gadd John. Mycotoxins: Cost/benefit ratio in swine production Feedstuffs, August 31, 2015.
5) Grenier, B., and I.P. Oswald. 2011. Mycotoxin co-contamination of food and feed: Meta-analysis of publications describing toxicological interactions. World Mycotoxin J. 4:285-313
6) Gunther Antonissen, An Martel, Frank Pasmans, Richard Ducatelle, Elin Verbrugghe Virginie Vandenbroucke, Shaoji Li, Freddy Haesebrouck, Filip Van Immerseel and Siska Croubels. The Impact of Fusarium Mycotoxins on Human and Animal Host Susceptibility to Infectious DiseasesToxins 2014, 6, 430-452; doi:10.3390/toxins6020430
7) Bouhet, S.; Oswald, I.P. The effects of mycotoxins, fungal food contaminants, on the intestinal epithelial cell-derived innate immune response. Vet. Immunol. Immun. 2005, 108, 199–209.
8) Oswald, I.P. Role of intestinal epithelial cells in the innate immune defence of the pig intestine. Vet. Res. 2006, 37, 359–368.
9) Schenk, M.; Mueller, C. The mucosal immune system at the gastrointestinal barrier. Best Pract. Res. CL GA 2008, 22, 391–409.
10) Pinton, P.; Nougayrède, J.-P.; Del Rio, J.-C.; Moreno, C.; Marin, D.E.; Ferrier, L.; Bracarense, A.-P.; Kolf-Clauw, M.; Oswald, I.P. The food contaminant deoxynivalenol, decreases intestinal barrier permeability and reduces claudin expression. Toxicol. Appl. Pharm. 2009, 237, 41–48.
11) Vandenbroucke, V.; Croubels, S.; Martel, A.; Verbrugghe, E.; Goossens, J.; van Deun, K.; Boyen, F.; Thompson, A.; Shearer, N.; de Backer, P. The mycotoxin deoxynivalenol potentiates intestinal inflammation by Salmonella Typhimurium in porcine ileal loops. PLoS One 2011, 6, doi: 10.1371/journal.pone.0023871.
12) Maresca, M. From the gut to the brain: Journey and pathophysiological effects of the food-associated trichothecene mycotoxin deoxynivalenol. Toxins 2013, 5, 784–820.
13) Antonissen G, Marte lA, Pasmans F, Ducatelle R, Verbrugghe E, Vandenbroucke V, et al. The impact of Fusarium mycotoxins on human and animal host susceptibility to infectious diseases. Toxins (Basel) 2014;6:430e52
14) Osselaere, A.; Devreese, M.; Goossens, J.; Vandenbroucke, V.; de Baere, S.; de Backer, P.; Croubels, S. Toxicokinetic study and absolute oral bioavailability of deoxynivalenol, T-2 toxin and zearalenone in broiler chickens. Food Chem. Toxicol. 2012, 51, 350–355.
15) Cysewski SJ, Wood RL, Pier AC, Baetz AL. Effects of aflatoxin on the development of acquired immunity to swine erysipelas. AmJVetRes1978;39:445e8.
16) Joens LA, Pier AC, Cutlip RC. Effects of aflatoxin consumption on the clinical course of swine dysentery. AmJVetRes1981;42:1170e2.
17) Savard C, Pinilla V, Provost C, Gagnon CA, Chorfi Y. In vivo effect of deoxynivalenol (DON) naturally contaminated feed on porcine reproductive and respiratory syndrome virus (PRRSV) infection. Vet Microbiol 2014;174:419e26.
18) Pestka JJ, Zhou HR, Moon Y, Chung YJ. Cellular and molecular mechanisms for immune modulation by deoxynivalenol and other trichothecenes unraveling a paradox. Toxicol Lett 2004;153:61e73.
19) Posa R, Donko T, Bogner P, Kovacs M, RepaI, Magyar T. Interaction of Bordetella bronchiseptica, Pasteurella multocida, and fumonisin B1 in the porcine respiratory tract as studied by computed tomography. Can J Vet Res 2011;75:176e82
20) Gan F, Zhang Z, Hu Z, Hesketh J, Xue H, Chen X, et al. Ochratoxin A promotes porcine circovirus type 2 replication in vitro and in vivo. Free Radic Biol Med 2015;80: 33e47.
21) Stoev SD, Goundasheva D, Mirtcheva T, Mantle PG. Susceptibility to secondary bacterial infections in growing pigs as an early response in ochratoxicosis. Exp Toxicol Pathol 2000;52:287e96.
22) Savard C, Gagnon CA, Chorfi Y. Deoxynivalenol (DON) naturally contaminated feed im pairs the immune response induced by porcine reproductive and respiratory syndrome virus (PRRSV) live attenuated vaccine. Vaccine 2015a;33:3881e6.
23) Caloni F, Ranzenigo G, Cremonesi F, Spicer L.Effects of trichotecene T-2 toxin on proliferation and steroid production by porcine granulosa cells. Toxicon 2009; 54 337-344.
24) Alix Pierron, ImouranaAlassane-Kpembi, IsabelleP.Oswald. Impact of mycotoxin on immune response and consequences for pig health Animal Nutrition (2016) 63-68
Comentarios (0)


 Español
Español  Inglés
Inglés