Para dejar un comentario Regístrate aquí o si ya tienes una cuenta debes Iniciar sesión

Porcinos
agosto 5, 2021
Fiebre Porcina Africana; una enfermedad emergente que pone en riesgo la porcicultura mundial.
Víctor Manuel Carrera Aguirre. Colaboradores: Jesús Munguía, Jesús Antonio Sánchez Sosa
La Fiebre Porcina Africana es una enfermedad de notificación obligatoria ante la Organización Mundial de Sanidad Animal (OIE) y tiene implicaciones económicas graves asociadas a pérdidas productivas, limitaciones comerciales y programas de erradicación costosas [Penrith ML 2009].
LA FIEBRE PORCINA AFRICANA (FPA), FUE DESCRITA POR PRIMERA VEZ EN EL CONTINENTE AFRICANO EN LA DÉCADA DE 1900’S. LA INFECCIÓN COMPRENDE UNA ALTA MORBILIDAD Y MORTALIDAD EN CERDOS DOMÉSTICOS (SUS SCROFA DOMESTICUS) CON AFECTACIONES DRÁSTICAS PARA LA PORCICULTURA MUNDIAL.
VIRUS DE LA FIEBRE PORCINA AFRICANA
Antiguamente, el Virus de la Fiebre Porcina Africana (VFPA) se clasificaba como miembro de la familia Iridoviridae y actualmente, es el único miembro del nuevo género Asfivirus de la familia Asfarviridae. Es el único virus conocido que se transmite por artrópodos. La virulencia de las cepas puede variar desde cepas altamente virulentas que producen la muerte de la mayoría de los cerdos, hasta cepas que sólo producen una ligera respuesta inmunológica.
Se han descrito 23 genotipos basados en las secuencias parciales del gen P72. Los 23 genotipos están presentes en África, mientras que solo los genotipos I y II se han encontrado fuera de ese continente. El virus infecta principalmente las células del sistema fagocítico mononuclear (monocitos y macrófagos) y se replica en el citoplasma. Se sabe que el retículo juega un papel importante en el ensamblaje viral y la envoltura de VFPA [Achenbach, 2017.]
COMPONENTES EPIDEMIOLÓGICOS DE LA ENFERMEDAD
La FPA se puede transmitir por contacto directo con los animales infectados, por contacto indirecto con fómites y por vectores como las garrapatas. La transmisión durante el contacto directo generalmente se produce por vía oronasal.
Los componentes principales en la epidemiología de la FPA se conocen desde la primera descripción de la enfermedad: garrapatas, jabalíes, cerdos domésticos y productos derivados de cerdo, así como el cerdo. Se ha confirmado que los jabalíes (Phacochoerus africanus) podrían ser una fuente de infección [Montgomery, 1921] y que este hospedador, junto con una especie de garrapatas (Ornithodoros spp.) que viven en madrigueras de jabalíes, podría infectarse persistentemente con el virus FPA sin mostrar signos de enfermedad [Plowright et al., 1969]. Las garrapatas de Ornithodoros spp. también están involucrados en la transmisión del VFPA. El jabalí no está presente en África, pero los suidos silvestres, incluidos los jabalíes (Phacochoerus africanus) y los cerdos salvajes (Potamochoerus larvatus) pueden infectarse de manera persistente y actuar como una fuente de infección, mientras que las garrapatas que habitan en las madrigueras de los cerdos silvestres también pueden participar en la transmisión.
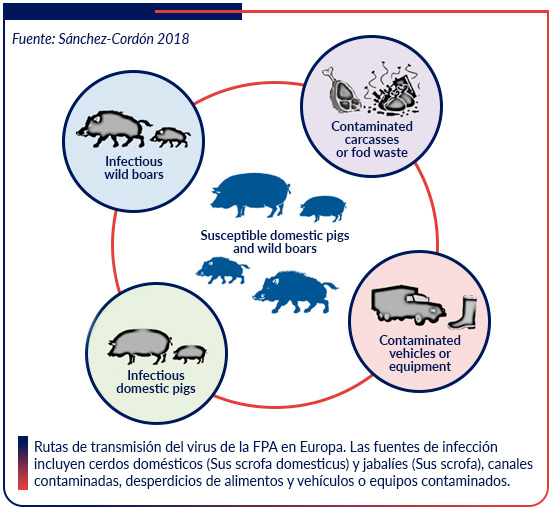
En el caso de los cerdos domésticos, el índice de morbilidad alcanza el 100% en las piaras que han sido expuestas por primera vez. El índice de mortalidad depende de la virulencia de la cepa, y puede oscilar entre 0% y 100%. Las cepas altamente virulentas pueden causar cerca del 100% de mortalidad en cerdos de todas las edades. Las menos virulentas tienen mayor probabilidad de ser mortales en cerdos con una enfermedad simultánea, hembras gestantes y animales jóvenes. En la forma subaguda de la enfermedad, el índice de mortalidad puede alcanzar el 70% u 80% en cerdos jóvenes, pero menos del 20% en animales adultos. La forma leve de la enfermedad o las infecciones asintomáticas generalmente se observan en jabalíes africanos y suinos potamoqueros de rio (Potamochoerus larvatus).
La epizootia de la peste porcina africana en los estados miembros de la Europa central y oriental tiene un componente recientemente identificado que involucra la transmisión del virus por el jabalí y la supervivencia del virus en el medio ambiente. Las perspectivas llevaron a una actualización de los 3 modelos aceptados de transmisión de la peste porcina africana para incluir un cuarto ciclo: hábitat de jabalí. El número de casos de FPA en poblaciones de jabalí ha aumentado dramáticamente en los últimos años. La evidencia apoya que el contacto directo con cerdos domésticos y jabalíes infectados, además del consumo de alimento contaminado, como las principales rutas de transmisión del virus VFPA a los cerdos domésticos [Claire Guinat et., al. 2016].
DIAGNÓSTICO Y VACUNACIÓN
El aislamiento viral se puede usar para el diagnóstico, aunque este método generalmente solo se usa en laboratorios de referencia para confirmar el diagnóstico. El bazo, los riñones, las amígdalas y los ganglios linfáticos son los mejores tejidos para su aislamiento. Por otra parte, se han desarrollado PCR convencionales y en tiempo real para la detección del VFPA. La respuesta inmune ante IgG detectada en cerdos domésticos que sobreviven a la infección, favorece el uso de ensayos serológicos ELISA, especialmente en regiones endémicas [Gallardo C et., al. 2015].
La vacunación es una de las mejores medidas de control para enfermedades infecciosas; sin embargo, el desarrollo de vacunas contra el VFPA ha sido detenido por grandes brechas en nuestro conocimiento de la infección e inmunidad sobre esta enfermedad. Hasta ahora, los antígenos protectores aún no se han identificado, lo que dificulta el diseño racional de las vacunas. Además, los mecanismos por los cuales el virus modula la respuesta del huésped a la infección son poco conocidos [Sánchez-Cordón 2018].
VÍAS DE ENTRADA, UN RIESGO LATENTE
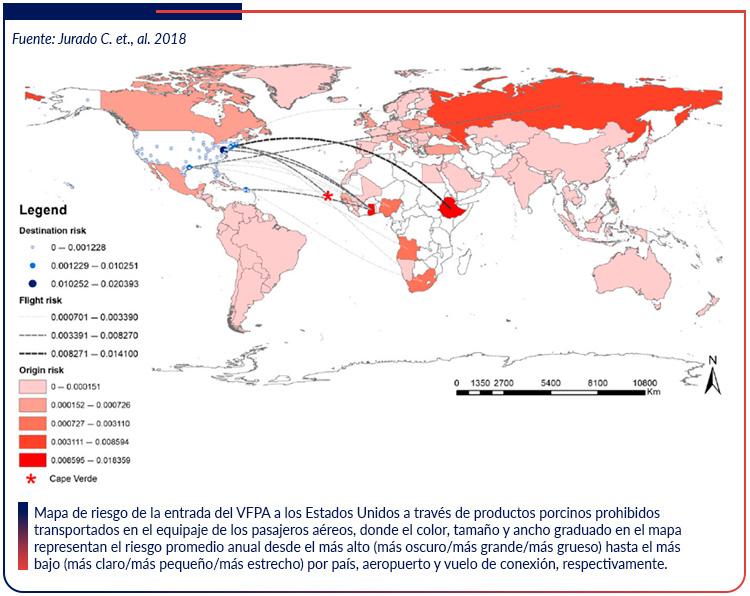
Se han evaluado las vías de la posible introducción de FPA en China y la evaluación de riesgos muestra rutas similares para la introducción del virus. El movimiento legal o ilegal de animales vivos o sus productos, subproductos, alimentos para animales, o una liberación viral intencional en un acto de bioterrorismo constituyen las rutas de mayor preocupación para la introducción del FPA en los Estados Unidos. Es importante tener en cuenta que para provocar un brote por el VFPA deberá liberarse en una población susceptible.
Además, el virus puede transmitirse mecánicamente a través de picaduras por moscas [Mellor et., al., 1987]. Por lo tanto, una posible ruta de introducción del VFPA en granjas de alta bioseguridad podría ser a través de moscas que se alimentan de sangre [Olesen et., al., 2018]. Tal modo de transmisión también podría ser una explicación para el número creciente de brotes observados durante el período de verano en cerdos domésticos en ciertos estados miembros de la UE [EFSA, 2017]. No se considera probable que la transmisión del virus dentro de las manadas de cerdos dependa de esta ruta, pero representa un posible mecanismo para la entrada inicial del virus en una población de cerdos en una granja.
Un brote inicial podría ocurrir en cerdos domésticos o silvestres y luego presumiblemente propagarse a la otra población. Después de una posible introducción, el establecimiento del VFPA, incluso el establecimiento a corto plazo, es una pregunta abierta.
Los ciclos de transmisión y la ecología viral a menudo difieren en distintas regiones, demostrando al menos cierta flexibilidad para que el virus persista en una variedad de climas, con o sin afectación del vector de garrapata y con o sin un componente de cerdos salvaje [Sanchez-Vizcaíno 2012].
El clima no limitaría el establecimiento del VFPA en los Estados Unidos, y hay especies de garrapatas que potencialmente podrían desempeñar un papel en el mantenimiento viral.
La presencia de porcinos de traspatio y porcinos silvestres también podría ayudar en el establecimiento a corto plazo similar a lo que se ha visto en otros lugares [Bellini S. et., al. 2016]
Los cerdos salvajes, que se encuentran en un gran número de estados, presentan un riesgo debido a su comportamiento libre y dietas omnívoras y en el caso de una incursión viral, probablemente contribuirían a los eventos transmisión a otros cerdos salvajes o sus contrapartes nacionales.
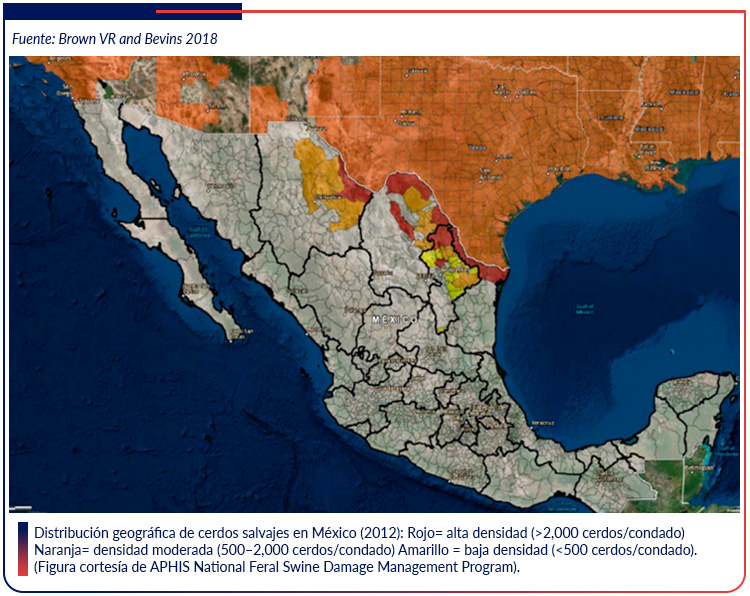
Los expertos de APHIS estiman que más de 6 millones de porcinos salvajes vagan en al menos 35 estados en los Estados Unidos, como California, Florida, Oklahoma y Texas que tienen la mayor población. Además de ser una especie invasora, los cerdos salvajes pueden dañar el medio ambiente y las operaciones agrícolas; alterar los ecosistemas con su comportamiento de enraizamiento que puede ser perjudicial para las especies amenazadas y en peligro de extinción; y representan una amenaza para la salud de los seres humanos, el ganado doméstico, la vida silvestre y los animales de compañía como resultado del tipo de patógenos que son capaces de transportar y transmitir.
Las poblaciones de cerdos salvajes se mueven de un país a otro, tanto en el norte como en el sur. Se desconoce si se ha realizado un censo detallado de las poblaciones de cerdos salvajes en México, pero hay poblaciones a lo largo de la frontera entre Estados Unidos y México que son contiguas a la población de cerdos salvajes de los Estados Unidos [Brown VR and Bevins 2018].
En promedio, 8,000 productos derivados de carne de cerdo son confiscados anualmente por Aduanas y Protección Fronteriza en los puertos de entrada del país. Estos productos porcinos con estado sanitario desconocido, podrían suponer un riesgo de introducción de enfermedades animales.
Según el conjunto de datos de USDA-APHIS, el 45% de los productos de carne de cerdo confiscados en los puertos de entrada de los E.U. fueron detenidos en aeropuertos internacionales transportados por pasajeros aéreos en su equipaje personal. De 2010 a 2015, el 81% del total de retenciones ocurrió en controles de aeropuertos y fronteras terrestres.
CONTROL E IMPACTO ECONÓMICO
Si bien FPA se describió por primera vez hace casi un siglo, el control de la enfermedad ha demostrado ser un desafío, en particular porque no hay vacunas disponibles. Tras la introducción a los países libres de VFPA, las únicas medidas de control disponibles son la cuarentena y la bioseguridad estrictas, las restricciones de movimiento de animales y el sacrificio de animales afectados o expuestos. El papel del jabalí en la propagación y el mantenimiento del VFPA son importantes; por ejemplo, de 2015 a 2017, se identificaron casi 8,000 jabalíes positivos al VFPA en Polonia y los países bálticos. La gran cantidad de virus se diseminó durante el período infeccioso de la enfermedad y el virus sobrevivió durante largos períodos en un entorno rico en proteínas, incluso en condiciones adversas [Penrith y Vosloo,] significa que el jabalí vivo infeccioso y sus canales deben considerarse en cualquier medida de control.
La OIE ha recomendado procedimientos para la detección precoz y planes de contingencia para peste porcina africana para el control de la FPA en cerdos domésticos y poblaciones de jabalíes La estrategia debe basarse en la detección precoz de la enfermedad y en la toma de estrictas medidas de control y bioseguridad [Sánchez-Vizcaíno JM]
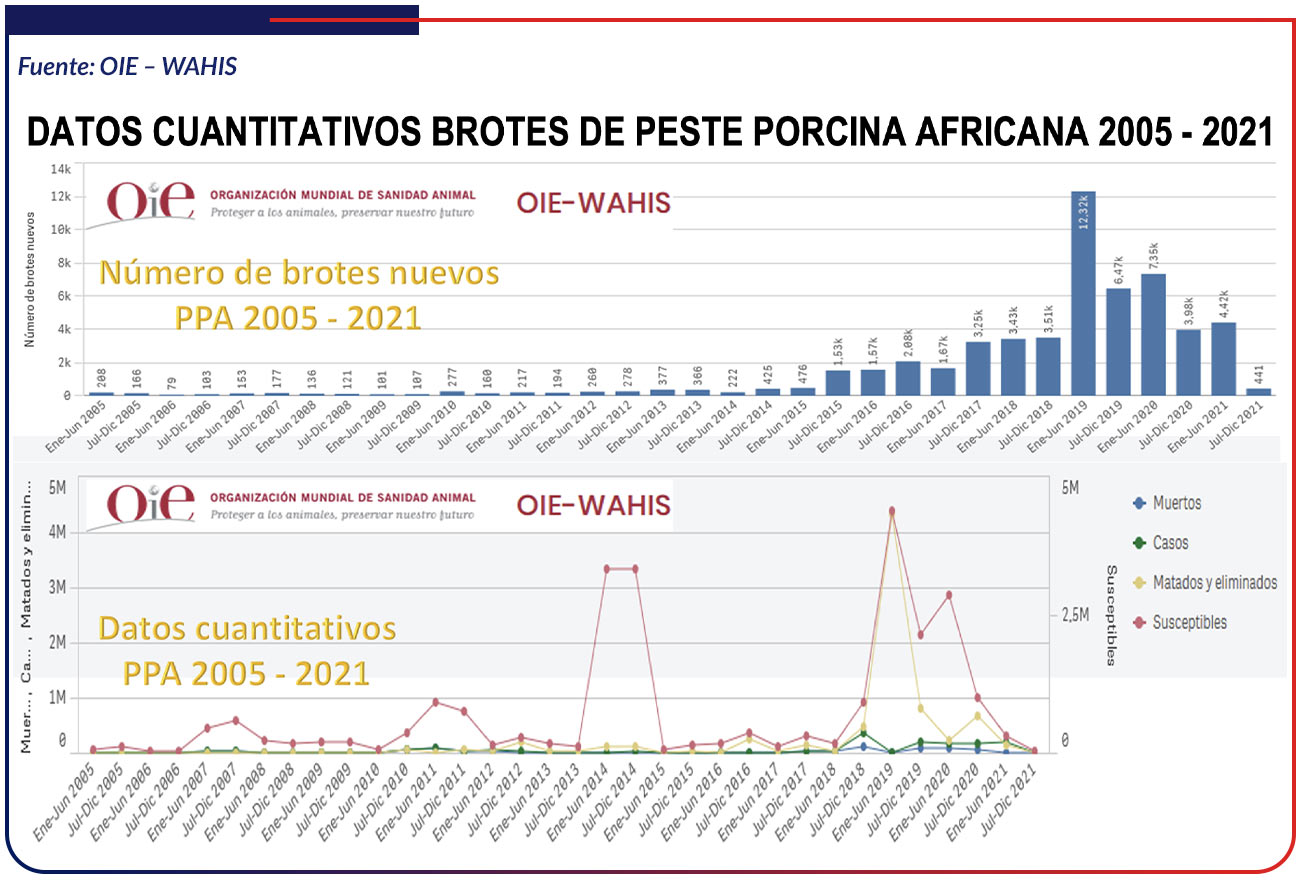
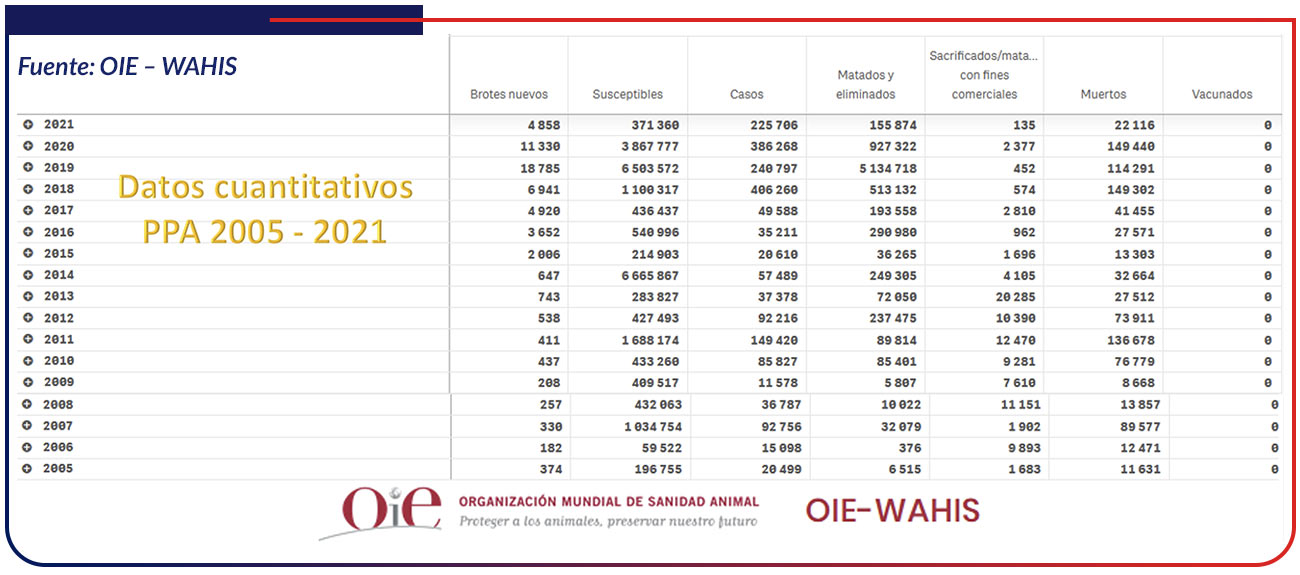
Es difícil producir cifras generales sobre los costos económicos de FPA y por lo tanto, las estimaciones pueden variar sustancialmente. Como resultado de los brotes de FPA en 2014 y 2015 en Polonia, Lituania, Letonia y Estonia, el valor de las exportaciones de carne de cerdo y productos porcinos se redujo en US $961 millones, que representan hasta el 50% de las exportaciones. La introducción del VFPA en Dinamarca podría resultar en pérdidas de US $ 12 millones en costos directos y US $ 349 millones en exportaciones [Halasa et al., 2016]. En Rusia, se estimó que FPA costó US $ 267 millones en 2017 La mayor propagación de la FPA a China podría tener consecuencias desastrosas, reconociendo que China contiene más de la mitad de la población de cerdos del mundo [Jurado C. et., al. 2018]
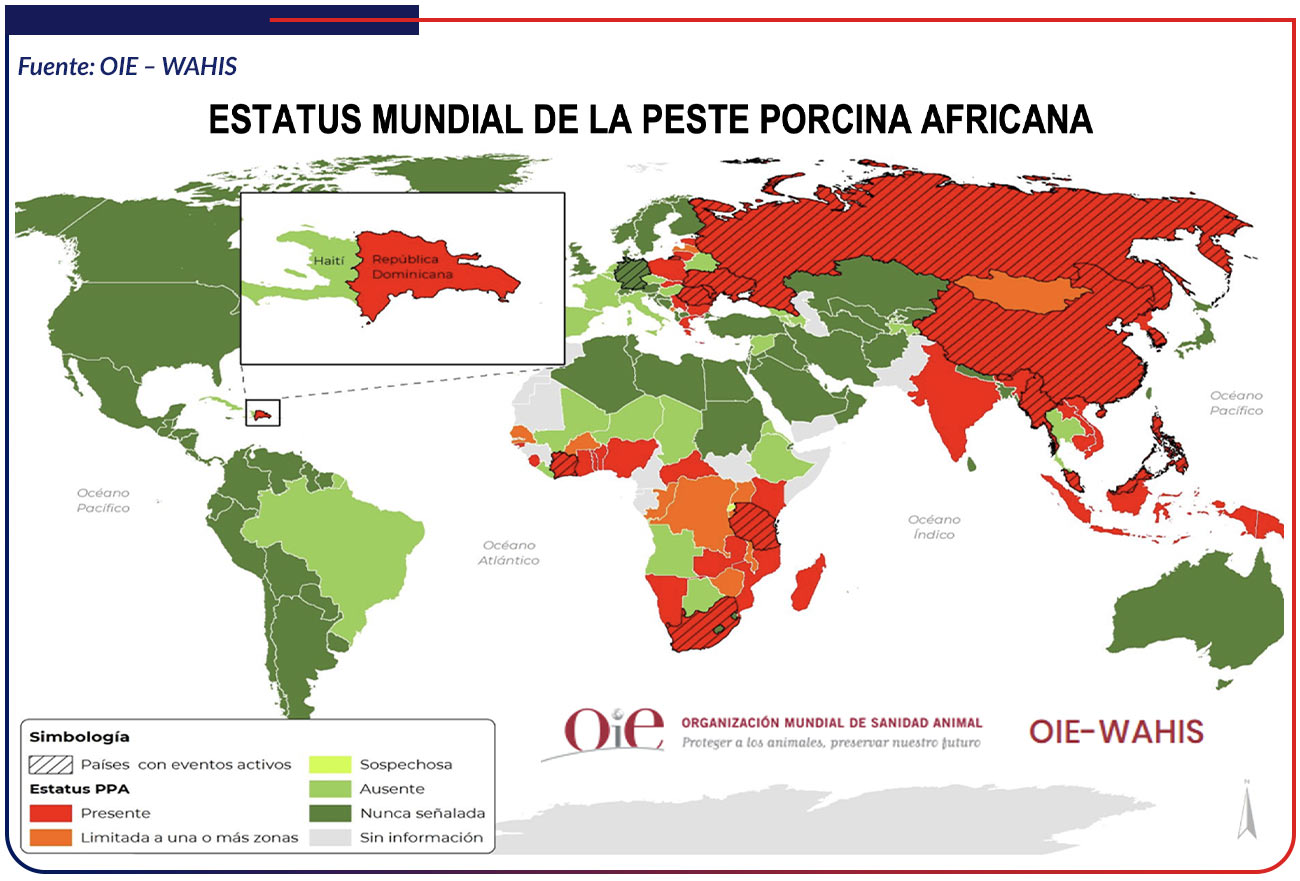
ESCENARIO MUNDIAL ACTUAL
Al notificarse esta enfermedad letal para los cerdos en la Región de las Américas por primera vez en casi 40 años, la Organización Mundial de Sanidad Animal (OIE) pide a los países que refuercen sus acciones de vigilancia. El Marco Mundial para el Control Progresivo de las Enfermedades Transfronterizas de los Animales (GF-TADs), una iniciativa conjunta de la OIE y la FAO, está brindando un apoyo fundamental.
La gran diversidad de los sistemas de producción y comercio que actualmente coexisten en la Región de las Américas plantean desafíos adicionales únicos a la hora de enfrentar esta enfermedad. Sin embargo, la situación no nos encuentra desprevenidos, ya que venimos anticipándonos a un evento como este desde hace varios años. Cuando la PPA llegó a Asia por primera vez en 2018, se convocó en la Región de las Américas a un grupo regional permanente de expertos bajo el marco del GF-TADs de manera de estar preparados para una posible introducción de la enfermedad. Este grupo ha estado proporcionando directrices críticas sobre la prevención de la enfermedad, la preparación y la respuesta, en línea con la iniciativa mundial para el control de la PPA.
CONCLUSIÓN
• La continua propagación del VFPA en África y Europa demuestra un potencial para una mayor propagación en otras regiones del mundo.
• La alta letalidad del VFPA en cerdos domésticos, la introducción de campañas de sacrificio masivo y las restricciones al movimiento de cerdos contribuyen al alto impacto socio-económico de la FPA en la producción porcina, el comercio mundial y los medios de vida de las personas.
• Aunque las Américas ya no está libre del VFPA, todavía es posible controlar su propagación a otros países mediante acciones proactivas, concretas y coordinadas por todas las partes interesadas de la región, tanto del sector privado como del público. Lograrlo será fundamental para proteger la seguridad alimentaria y el sustento de algunas de las poblaciones más vulnerables del mundo frente a esta devastadora enfermedad porcina.
• También deben considerarse acciones prioritarias para aumentar significativamente el nivel de sensibilización sobre la enfermedad. Para este fin, una campaña de comunicación de la OIE está disponible en varios idiomas para apoyar a los países en sus esfuerzos
REFERENCIAS BIBLIOGRÁFICAS
1) Penrith ML, Vosloo W. Review of African swine fever: transmission, spread, and control. J S Afr Vet Assoc (2009) 80:58–62. doi:10.4102/jsava.v80i2.172.
2) Plowright, W., Parker, J., Peirce, M.A., 1969. African swine fever virus in ticks (Ornithodoros moubata, Murray) collected from animal burrows in Tanzania. Nature 221, 1071–1073.
3) Montgomery, R., 1921. A form of swine fever occurring in British East Africa (Kenya Colony). Journal of Comparative Pathology 34, 159–191.
4) Achenbach JE, Gallardo C, Nieto-Pelegrin E, Rivera-Arroyo B, Degefa- Negi T, Arias M, et al. Identification of a new genotype of African swine fever virus in domestic pigs from Ethiopia. Transbound Emerg Dis (2017) 64:1393–404. doi:10.1111/tbed.12511
5) Sánchez-Cordón PJ, M. Montoya, A.L. Reis, L.K. Dixon. African swine fever: A re-emerging viral disease threatening the global pig industry. The Veterinary Journal 233 (2018) 41–48
6) Mellor, P.S., Kitching, R.P., Wilkinson, P.J., 1987. Mechanical transmission of capripox virus and African swine fever virus by Stomoxys calcitrans. Res. Vet. Sci. 43, 109–112.
7) Olesen, A.S., Lohse, L., Hansen, M.F., Boklund, A., Halasa, T., Belsham, G.J., Rasmussen, T.B., Botner, A., Bodker, R., 2018. Infection of pigs with African swine fever virus via ingestion of stable flies (Stomoxys calcitrans). Transbound. Emerg. Dis. E-Pub. http:// dx.doi.org/10.1111/tbed.12918.
8) EFSA (European Food Safety Authority), Cortinas Abrahantes, J., Gogin, A., Richardson, J., Gervelmeyer, A., 2017. Scientific report on epidemiological analyses on African swine fever in the Baltic countries and Poland. EFSA J. 15 (4732), 1–73.
9) Halasa, T., Botner, A., Mortensen, S., Christensen, H., Toft, N., Boklund, A., 2016. Simulating the epidemiological and economic effects of an African swine fever epidemic in industrialized swine populations. Veterinary Microbiology 193, 7– 16.
10) Claire Guinat, Andrey Gogin, Sandra Blome, Guenther Keil, Reiko Pollin, Dirk U. Pfeiffer, Linda Dixon. Transmission routes of African swine fever virus to domestic pigs: current knowledge and future research directions. Veterinary Record (2016) 178, 262-267 doi: 10.1136/vr.103593
11) Gallardo C, Nieto R, Soler A, Pelayo V, Fernandez-Pinero J, Markowska- Daniel I, et al. Assessment of African swine fever diagnostic techniques as a response to the epidemic outbreaks in Eastern European counties: how to improve surveillance and control programs. J Clin Microbiol (2015) 53:2555–65. doi:10.1128/JCM.00857-15.
12) Vergne T, Chen-Fu C, Li S, Cappelle J, Edwards J, Martin V, et al. Pig empire under infectious threat: risk of African swine fever introduction into the People’s Republic of China. Vet Rec (2017) 10:1–7. doi:10.1136/ vr.103950
13) Sanchez-Vizcaino JM, Martinez-Lopez B. African swine fever: an epidemiological update. Transbound Emerg Dis (2012) 59:45–50. doi:10.0000/j.1865-1682.2011.01293.x
14) Bellini S, Rutili D, Guberti V. Preventive measures aimed at minimizing the risk of African swine fever virus spread in pig farming systems. Acta Vet Scand (2016) 58:1–10. doi:10.1186/s13028-016-0264-x
15) Brown VR and Bevins SN (2018) A Review of African Swine Fever and the Potential for Introduction into the United States and the Possibility of Subsequent Establishment in Feral Swine and Native Ticks. Front. Vet. Sci. 5:11. doi: 10.3389/fvets.2018.00011.
16) Cristina Jurado, Giulia Paternoster, Beatriz Martínez-López, Kenneth Burton, Lina Mur. Could African swine fever and classical swine fever viruses enter into the United States via swine products carried in air passengers’ luggage? Transbound Emerg Dis. 2018;1–15. DOI: 10.1111/tbed.12996.
Comentarios (0)


 Español
Español  Inglés
Inglés